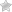Главная › База знаний ›
12.02.2019
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.
Что такое электролиз?
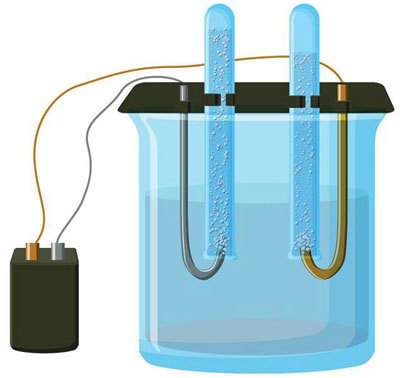
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока.
Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация.
Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду.
Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла).
На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.

Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:

k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
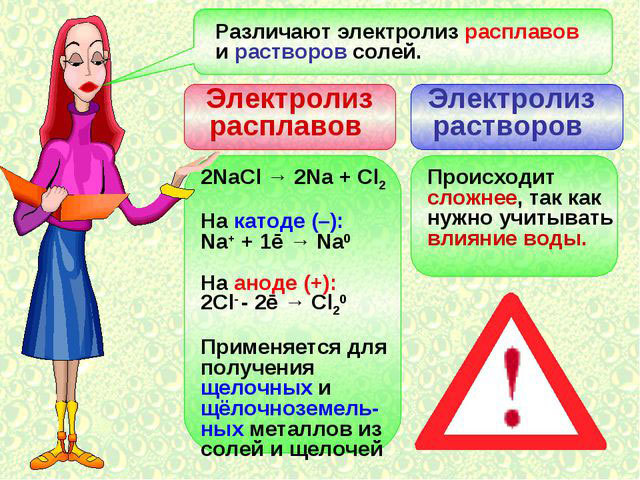
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль).
К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.
) из расправа соответствующих солей.
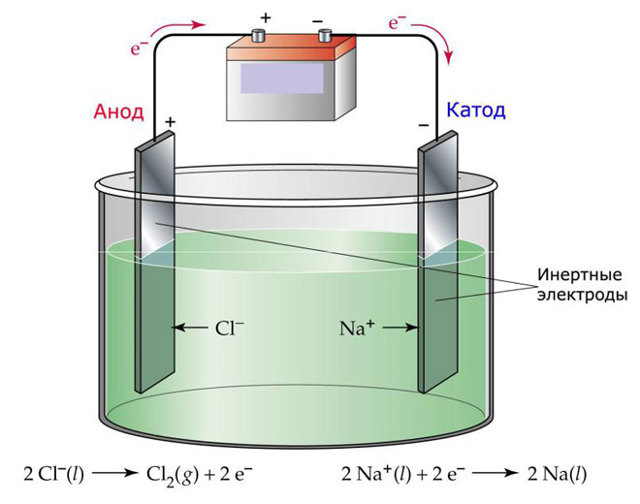
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии.
Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0».
Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
Клетка Фарадея своими руками
При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.

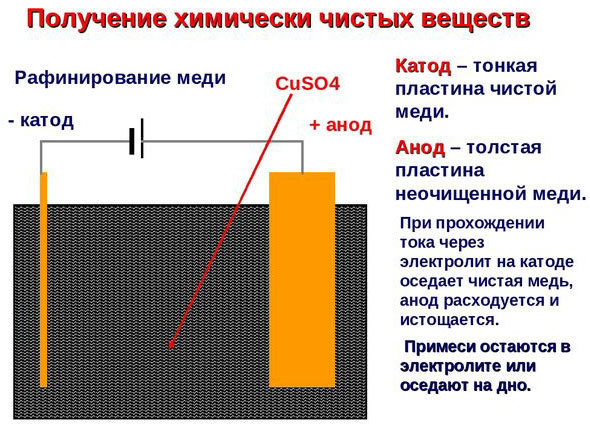
Электроочистка — рафинирование меди
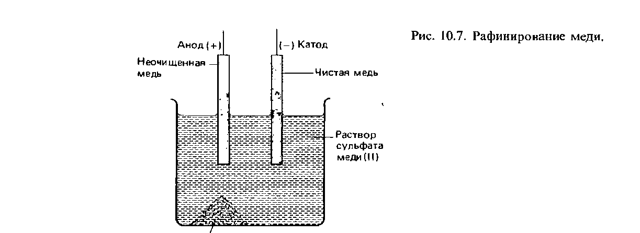
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
Добыча металлов
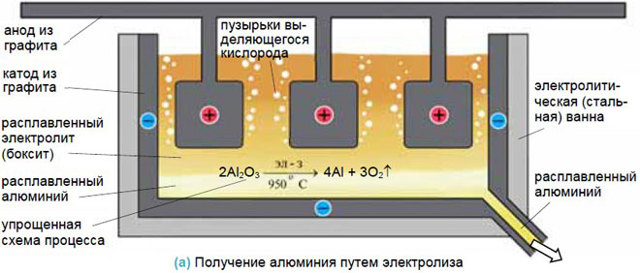
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты.
В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности.
Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии.
Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления.
Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
Что такое электролиз и где он применяется? Ссылка на основную публикацию 
Источник: https://odinelectric.ru/knowledgebase/chto-takoe-electroliz
Применение электролиза
Электролиз широко используется в металлургии для получения чистых металлов. Процесс ведется с растворимыми или с нерастворимыми анодами в растворе или в расплаве солей.

Применении электролиза в металлургии.
В первом случае анодом служит неочищенный металл. Он электролитическим путем переводится в раствор, а затем в очищенном виде осаждается на катоде. Примером электролиза с растворимым анодом может служить электролитическое рафинирование (от франц. слова «raffiner»—очищать) меди.
Процесс электролиза протекает согласно вышеописанной схеме в электролитической ванне, заполненной раствором сернокислой меди CuS04; анодами служат плиты, отлитые из неочищенной меди, между ними помещаются тонкие (1 мм) листы чистой меди.
При электролизе медь анодов переходит в раствор, а затем осаждается на катодах; примеси выпадают на дно ванны в виде шлама (осадка). Расход электроэнергии при этом составляет 300 квт/ч на тонну. Электролитическая медь содержит менее 0,1% примесей. Это очень существенно увеличивает ее удельную проводимость.
Удельная проводимость меди с примесями (порядка 1,5%) 57, а электролитической меди — 61. Высокая чистота металлов является существенным преимуществом электролитического способа их получения.
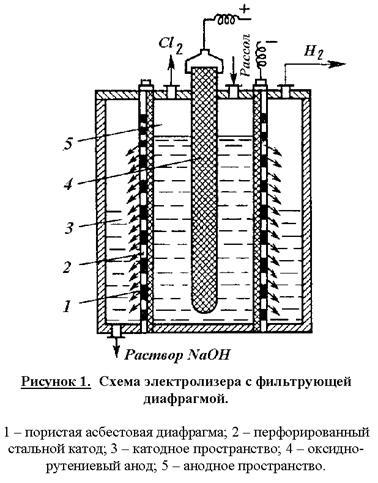
Схема электролизера с фильтрующей диафрагмой.
Примером электролиза в расплавленной среде с нерастворимым анодом может служить получение алюминия из криолитоглиноземных расплавов. Дно ванны (подина) служит катодом электролизера, а угольные блоки, подвешенные в ванне — анодом.
Ванна заполняется расплавленным электролитом, температура которого при нормальном ходе процесса должна быть около 950°С. Эта температура поддерживается теплом, выделяемым током, проходящим через ванну.
Электролиз глинозема (окиси алюминия) вызывает его распад на металлический алюминий, выделяющийся на катоде, на дне ванны, и на кислород. Последний с углеродом анода образует окись углерода СО и углекислый газ С02.
Вследствие электролиза содержание глинозема в электролите уменьшается, поэтому для поддержания концентрации электролита в него периодически добавляется глинозем, и электролит перемешивается. На получение 1 т алюминия затрачивается 17 500 квт/ч электроэнергии.
Вообще, на электролиз металлов в расплавах требуется значительно большие затраты электроэнергии, чем на электролиз в водных средах. Но для ряда металлов электролиз возможен только в расплавах.
Электрометаллургия алюминия является одним из крупнейших промышленных потребителей электроэнергии, поэтому целесообразно строительство сответствующих заводов близ источников дешевой электроэнергии — мощных гидроэлектростанций (например, Днепровский алюминиевый завод близ Днепрогэса).
Очень широка область применения электролиза в химической промышленности. В частности, путем электролиза получается ряд химикалий, необходимых для производства минеральных удобрений.
Для получения очень чистых водорода и кислорода применяют электролиз водного раствора едкого натра при никелевых электродах. Водород в химических реакциях подобен металлам, поэтому он выделяется на катоде, а на аноде выделяется кислород. Расход электроэнергии для получения 1 м3 водорода и 0,5 м3 кислорода составляет 4,5 квт/ч.
Источник: https://fazaa.ru/uroki-elektrotexniki/primenenie-elektroliza.html
Промышленные применения электролиза
Извлечение металлов
Извлечение металлов первой и второй групп периодической системы осуществляется с помощью электролиза из расплавленных галогенидов этих металлов.
Например, натрий получают электролизом расплавленного хлорида натрия в электролизере Даунса. Магний получают электролизом хлорида магния, который в свою очередь получают из доломита и морской воды.
Подробное описание этих и других способов получения металлов приведены в других местах книги, которые указаны в табл. 10.4.
Таблица 10.4. Способы электролитического получения металлов
| Металл | Сырье | Электролит | Ион, разряжаемый на катоде | См. разд. |
| Алюминий | Бокситная руда | Al2O3, растворенный в расплавленном криолите | Al3 + | 15.1 |
| Кальций | Хлорид кальция-отходы процесса Сольве (производство Na2CO3) | CaCl2 | Ca2 + | 13.3 |
| Магний | Доломит и морская вода | MgCl2 | Mg2 + Na+ | 13.3 |
| Натрий | Каменная соль | NaCl | 13.3 | |
| Цинк | ZnS-руда (цинковая обманка) | ZnSO4 | Zn2 + | 10.5 |
Очистка металлов
Очистка таких металлов, как медь и цинк, может осуществляться с помощью электролиза. Очистка металлов называется рафинированием (см. разд. 10.5). На рис. 10.7 схематически изображен процесс очистки меди. Неочищенная медь играет в этом процессе роль анода, а очищенная медь-роль катода; в качестве электролита может использоваться раствор сульфата меди(II). На аноде протекает полуреакция
Сu(тв.) =Cu2+(водн.) + 2е-
Примеси, высвобождаемые при растворении неочищенной меди на аноде, опускаются на дно электролизера, образуя так называемый анодный ил. Этот ил может содержать драгоценные металлы, например золото и серебро. Переходящие в раствор ионы меди разряжаются и осаждаются на чистом медном катоде. Эта полуреакция описывается уравнением
Cu2 +(водн.) = Сu(тв.) + 2е-
Примеси (анодный ил)
Нанесение гальванических покрытий
В этом процессе нанесение покрытия (электроосаждение) осуществляется на катоде. Катод погружают в электролит, который содержит ионы электроосаждаемого металла.
В качестве анода используется пластина или стержень из того металла, которым наносят покрытие.
Для успешного проведения электроосаждения следует тщательно контролировать силу электрического тока, концентрацию электролита и температуру. Кроме того, необходимо предварительно подвергнуть очистке катод.
Нанесение гальванического покрытия может включать целый ряд стадий. Например, покрытие железа хромом включает четыре стадии:
1. Очистка железного предмета, играющего роль катода, при помощи серной кислоты с последующей промывкой деионизированной водой.
2. Покрытие железного катода медью.
3. Последующее покрытие катода никелем с целью предотвращения коррозии.
4. Окончательное покрытие предмета хромом.
Анодирование
Так называется процесс покрытия алюминиевых предметов оксидом алюминия. В этом процессе покрываемый предмет играет роль анода, а в качестве электролита используется разбавленная серная кислота. Покрытие из оксида алюминия предохраняет предмет от коррозии.
Получение химических веществ
Важнейшим примером подобного применения электролиза является получение гидроксида натрия, водорода и хлора в электролизере с ртутным катодом. Подробное описание этого процесса приводится в разд. 13.3.
Электрофорез
На поверхности коллоидных частиц, взвешенных в растворе, часто имеются электрические заряды из-за адсорбции ионов или электронов. Например, частицы золота в водном золе золота адсорбируют на своей поверхности гидроксидные ионы.
При пропускании электрического тока через золь отрицательно заряженные частицы золя мигрируют к аноду (рис. 10.8). Миграция заряженных коллоидных частиц к какому-либо электроду называется электрофорез.
(Другое название электрофореза-катафорез.)
Электрофорез находит важные применения в технике, медицине и биохимии. Он может использоваться для разделения, идентификации и количественного определения белков и жиров (см. разд. 20.3) в крови.
Источник: https://www.himikatus.ru/art/ch-act/0485.php
Применение электролиза
- Доклад ученицы 10 кл. «Б»
- школы 1257
- Масоловой Елены по теме:
- Применение электролиза.
- Сущность электролиза.
- Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов.
- Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу — анод, после чего погружают их в электролизер с раствором или расплавом электролита.
- Электроды, как правило, бывают металлические, но применяются и неметаллические, например графитовые (проводящие ток).
На поверхности электрода, подключенного к отрицательному полюсу источника постоянного тока (катоде), ионы, молекулы или атомы присоединяют электроны, т. е.
протекает реакция электрохимического восстановления. На положительном электроде (аноде) происходит отдача электронов, т. е. реакция окисления. Таким образом, сущность электролиза состоит в том, что на катоде происходит процесс восстановления, а на аноде — процесс окисления.
В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления, которые в зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т. п., — так называемые вторичные процессы.
Металлические аноды могут быть: а) нерастворимыми или инертными (Pt, Au, Ir, графит или уголь и др.), при электролизе они служат лишь передатчиками электронов; б) растворимыми (активными); при электролизе они окисляются.
В растворах и расплавах различных электролитов имеются разноименные по знаку ионы, т. е. катионы и анионы, которые находятся в хаотическом движении.
Но если в такой расплав электролита, например расплав хлорида натрия NaCl, опустить электроды и пропускать постоянный электрический ток, то катионы Na+ будут двигаться к катоду, а анионы Cl– — к аноду.
На катоде электролизера происходит процесс восстановления катионов Na+ электронами внешнего источника тока:
- Na+ + e– = Na0
- На аноде идет процесс окисления анионов хлора, причем отрыв избыточных электронов от Cl– осуществляется за счет энергии внешнего источника тока:
- Cl– – e– = Cl0
- Выделяющиеся электронейтральные атомы хлора соединяются между собой, образуя молекулярный хлор: Cl + Cl = Cl2, который и выделяется на аноде.
- Суммарное уравнение электролиза расплава хлорида натрия:
- 2NaCl —> 2Na+ + 2Cl– —электролиз—> 2Na0 + Cl20
Окислительно-восстановительное действие электрического тока может быть во много раз сильнее действия химических окислителей и восстановителей. Меняя напряжение на электродах, можно создать почти любой силы окислители и восстановители, которыми являются электроды электролитической ванны или электролизера.
Известно, что ни один самый сильный химический окислитель не может отнять у фторид-иона F– его электрон. Но это осуществимо при электролизе, например, расплава соли NaF. В этом случае на катоде (восстановитель) выделяется из ионного состояния металлический натрий или кальций:
- Na+ + e– = Na0
- на аноде (окислитель) выделяется ион фтора F–, переходя из отрицательного иона в свободное состояние:
- F– – e– = F0 ; F0 + F0 = F20
- -Продукты, выделяющиеся на электродах, могут вступать между собой в химическое взаимодействие, поэтому анодное и катодное пространство разделяют диафрагмой.
- Практическое применение электролиза.
Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии и т. д.
В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д.
При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.).
Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов. Электролиз может осуществляться с растворимыми анодами — процесс электрорафинирования или с нерастворимыми — процесс электроэкстракции.
Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах.
В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др.
Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов в электролизер. При пропускании тока металл, подлежащий очистке, подвергается анодному растворению, т. е.
переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде, благодаря чему образуется компактный осадок уже чистого металла.
Примеси, находящиеся в аноде, либо остаются нерастворимыми, либо переходят в электролит и удаляются.
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника пожразделяется на гальваностегию и гальванопластику.
¨ Гальваностегия (от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается (сцепляется) с покрываемым металлом (предметом), служащим катодом электролизера.
Перед покрытием изделия необходимо его поверхность тщательно очистить (обезжирить и протравить), в противном случае металл будет осаждаться неравномерно, а кроме того, сцепление (связь) металла покрытия с поверхностью изделия будет непрочной.
Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля. С помощью электролиза можно наносить тончайшие металлические покрытия на различных металлических поверхностях.
При таком способе нанесения покрытий, деталь используют в качестве катода, помещенного в раствор соли того металла, покрытие из которого необходимо получить. В качестве анода используется пластинка из того же металла.
¨ Гальванопластика– получение путем электролиза точных, легко отделяемых металлических копий относительно значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами.
С помощью гальванопластики изготовляют бюсты, статуи и т. д.
Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование «накладного» слоя никеля, серебра, золота и т. д.).
- Кроме указанных выше, электролиз нашел применение и в других областях:
- -получение оксидных защитных пленок на металлах (анодирование);
- -электрохимическая обработка поверхности металлического изделия (полировка);
- -электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
- —очистка воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
-электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).
Источник: https://mirznanii.com/a/326147/primenenie-elektroliza
Электролиз
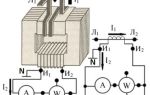
Электролиз — это процесс разложения вещества под действием электрического тока (electric current).
История открытия электролиза
Слово электролиз происходит от греческого (ἤλεκτρον) [ɛ̌ːlektron] «янтарь» и λύσις [lýsis] «растворение».
Небольшая хронология истории электролиза:
- 1785 г. — Мартинуса ван Марум использовал электростатический генератор, чтобы осадить (извлечь) олово, цинк и сурьму из их солей с использованием электролиза (Энциклопедия Британника 3-е издание (1797), том 1, стр 225).
- 1800 г. — Уильям Николсон и Энтони Карлайл (при участии Иоганн Риттер) разложили воду на водород и кислород.
- 1807 г. — такие химические элементы как: калия, натрия, бария, кальция и магния были обнаружены сэром Хамфри Дэви с помощью электролиза.
- 1833 г. — Майкл Фарадей открывает свои два закона электролиза, и даёт их математическую формулировку и объяснение.
- 1875 г. — Поль Эмиль Лекок де Буабодран обнаружили галлий с помощью электролиза.
- 1886 г. — был обнаружен Фтор Анри Муассаном с помощью электролиза.
- 1886 г. — Разработан процесс Холла-Эру для получения алюминия из глинозёма.
- 1890 г. — Разработан Castner–Kellner процесс получения гидроксида натрия.
Краткое описание электролиза
Электролиз происходит при прохождении постоянного (прямого) электрического тока через ионизированное вещество, которое может быть или расплавом, или раствором, в котором это самое вещество распадается на ионы (электролитическая диссоциация молекул) и представляет собой электролит. При прохождении электрического тока через такое состояние вещества, когда оно представлено ионами, происходит электрохимическая реакция окисления и восстановления.
На одном электроде ионы одного вида будут окислятся, а на другом восстанавливаться, что весьма часто проявляется в виде выделения газов, или выпадением вещества в виде нерастворимого химического осадка. При электролизе ионы, называемые анионами получают недостающие им электроны и перестают быть ионами, а ионы другого вида — катионы, отдают лишние электроны и также перестают после этого быть ионами.
Электролиз не может происходить там, где отсутствуют ионы, например в кристалле соли, или в твёрдых полимерах (смолы, пластмассы).
Если кристалл соли растворить в подходящем растворителе, в котором он распадётся на ионы, то в такой жидкой среде возможен процесс электролиза, так как раствор представляет собой электролит.
Все электролиты являются проводниками второго рода, в которых может существовать электрический ток.
Для процесса электролиза необходимо как минимум два электрода, которые представляют собой источник тока. Между этими двумя электродами через электролит или расплав протекает электрический ток, а наличие только одного электрода не обеспечивает замкнутую электрическую цепь, и потому ток протекать не может.
В качестве электродов могут быть использованы любые материалы обеспечивающие достаточную проводимость. Это могут быть металлы и их сплавы, графит, полупроводниковые материалы.
Электрохимические свойства электродов имеют решающее значение в коммерческом (промышленном) использовании электролиза, так как могут существенно снизить стоимость производства, улучшить качество и скорость электрохимического процесса, которым и является электролиз.
Процесс электролиза
Вся суть процесса электролиза заключается в превращении ионов раствора (расплава) в атомы через добавление или отнятие электронов. Такое изменение происходит благодаря внешней электрической цепи, в которой существует электрический ток.
В такой цепи обязательно имеется источник электричества, который является поставщиком электронов на одном электроде — катоде, и своеобразным насосом выкачивающем электроны на другом электроде — аноде.
На катоде всегда избыток электронов и в его сторону движутся катионы (+), чтобы получить недостающие электроны и стать атомами, а на аноде — недостаток электронов и в его сторону движутся анионы (-), которые имеют лишние электроны на своей орбите, с тем, чтобы отдать их и стать нейтральными атомами.
В результате электрический ток в жидкости приводит к химическим превращениям веществ, то есть происходит химическая реакция. Любая химическая реакция связана с электричеством. Атомы и молекулы меняют свои заряды (валентность), окисляются и восстанавливаются, если говорить языком химии.
Очень часто процесс электролиза сопровождается физическим явлением газообразования. Например, при электролизе раствора поваренной соли в воде образуются газообразные хлор и водород.
Во всяком случае, когда используются водные растворы (электролиты), будет на катоде выделятся водород.
При использовании в качестве электролита раствора медного купороса CuSO4 (сульфат меди II) на катоде будет осаждаться кристаллическая медь.
Процесс электролиза является обратным тому процессу, который происходит в гальванических элементах при их использовании. Если при электролизе восстанавливается цинк, то в гальваническом элементе он окисляется.
Энергетические затраты
Процесс электролиза — это в основном энергозатратный процесс, при котором тратится энергия на окислительно восстановительные реакции химических элементов.
Так, например, при электролизе воды будет восстанавливаться водород и окислятся кислород.
Если весь полученный водород и кислород в результате электролиза сжечь, то будет выделена теплота (энергия), которая была затрачена при электролизе.
Электролиз как технический процесс имеет сопутствующие затраты энергии, которые могут быть уменьшены. Эти затраты являются паразитными, к таким относится нагрев электролита при прохождении через него электрического тока. Все побочные затраты теоретически могут быть сведены к нулю. Однако, как и любой другой технический процесс, электролиз не может иметь КПД более 100%.
В некоторых случаях, например при электролизе водяного пара при высокой температуре, тепловая энергия поглощается извне, и поэтому при сгорании полученного водорода выделяется больше тепла, чем было затрачено на электролиз.
Законы Фарадея
- В 1832 году Майкл Фарадей объявил всему научному миру свои два закона электролиза.
- Первый закон электролиза:
- Масса вещества, образующегося на электроде прямо пропорциональна количеству электричества прошедшему через расплав (электролит).
- Второй закон электролиза:
- Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
- Эти два закона позволяют определить количество электричества (в кулонах), которое необходимо пропустить через расплав (электролит), чтобы получить определённое количество вещества так или иначе выделенного на электроде.
Одинаковое количество электричества в электролизе приведёт к восстановлению или окислению различной массы вещества в зависимости от малярной массы и валентности. Чем меньше валентность и чем больше молярная масса вещества, тем меньшее количество электричества требуется для восстановления (окисления) одного грамма этого вещества.
Дата: 17.06.2015
© Valentin Grigoryev (Валентин Григорьев)
Источник: https://electricity-automation.com/page/elektroliz-bazovoye-predstavleniye
Применение электролиза в производстве металлов: в чем заключается процесс и его применения
Сетевые электрические шуруповерты: какие лучше выбрать, рейтинги
Сетевой шуруповерт: рейтинг производителей. Какие сетевые электрические шуруповерты лучше: параметры для выбора. Питание от сети или аккумулятора: преимущества и недостатки. Основные характеристики сетевых электрических шуруповертов….
24 02 2020 21:18:59
Физическая формула расчета эквивалентного сопротивления в цепи
Определение эквивалентного сопротивления. Разница в методике определения эквивалентного сопротивления в цепях с последовательным и параллельным соединением элементов. Расчёт при смешанном соединении устройств. Физические формулы, примеры вычислений….
08 02 2020 20:47:59
Прокладываем кабель в гофрированной трубе с проволокой
Виды размещения электрической проводки. Виды гофрированной трубы для прокладки электропровода. Этапы прокладывания электропроводки с использованием гофротрубы. Сферы применения гофрированных труб….
05 02 2020 17:18:14
Об основных мерах по защите от поражений электрическим током
Требования и нормативы по основным мерам защиты от поражения электрическим током. Технические термины основных нормативных документов. Основные мероприятия по безопасности. Комплекс защитных мероприятий и индивидуальные средства защиты….
04 02 2020 19:13:18
Проверка сопротивления резистора с помощью мультиметра
Признаки повреждения резисторов. Проверка сопротивления мультиметром. Порядок проверки «подозрительного» резистора. Переменный резистор: правила проверки (прозвона). Измеряем позистор. Мультиметр: правила эксплуатации….
31 01 2020 8:58:42
Самонесущий изолированный силовой электрокабель
Что такое провод С И П: характеристика самонесущего изолированного провода, конструкция и состав. Преимущества С И П-кабеля. Виды кабелей С И П, правила монтажа самонесущих изолированных проводов….
24 01 2020 5:10:47
Как проверить аккумулятор прибором мультиметр (вольтметр)
Необходимые параметры для проверки А К Б мультиметром. Измерение напряжения и емкости аккумуляторной батареи. Последовательность действий для определения внутреннего сопротивления аккумулятора. Проверка тока утечки с помощью мультиметра….
11 01 2020 9:56:56
Ряды номиналов резисторов: сопротивление номинала Е 24
Как образуется типовой ряд номиналов резисторов. Технологические нюансы производства радиотехнических изделий. Особенность изготовления резистивных элементов. Ряды сопротивлений резистора: таблица. Ряд сопротивления Е24….
01 01 2020 19:57:37
Как отремонтировать стабилизатор напряжения своими руками
Диагностика повреждений и методика проверки стабилизатора. Ремонт электромеханических и релейных стабилизаторов напряжения. Ремонт платы управления стабилизатора своими руками. Степень сложности ремонта различных видов стабилизаторов….
13 12 2019 10:51:14
Принцип работы и разновидности инфракрасных датчиков движения
Разновидности и особенности И К-датчиков: извещатели скорости, детекторы PIR, съемные сенсоры и т.п. Способы расположения и схемы инфракрасных датчиков. Принцип работы датчиков движения. Критерии выбора инфракрасного датчика движений….
22 11 2019 23:40:43
Технические характеристики и расшифровка ВВГ 2-кабелей
Маркировка установочных проводов и кабелей согласно Г О С Ту. Конструкция В В Г 2: требования предъявляемые к изоляции провода. Технические характеристики кабелей В В Г-2. Конструктивные характеристики проводов В В Г2….
21 11 2019 9:46:47
Гибкие кабель-каналы для проводки: назначение и правила монтажа
Разновидность кабель каналов: цепеобразный, трубчатый (гофрированный), секционный. Различие гибких каналов для кабеля по способу укладки и типу. Сфера применения, требования пожарной и электробезопасности к гибкому каналу для кабелей….
18 11 2019 1:38:15
Степени защиты электрических розеток (IP)
Сейчас существует множество видов розеток, но для разных потребностей существуют различные методы их защиты. Мы расскажем как в них ориентироваться….
14 11 2019 4:22:15
Гарантирующий поставщик электроэнергии
Границы зон деятельности, получение статуса гарантирующего поставщика, а также заключение договора с физическими и юридическими лицами….
09 11 2019 13:55:33
Примеры магнитной (диамагнитной) левитации, диамагнетизм
Определение магнитной (диамагнитной) левитации. Магнитная левитация: эксперименты в домашних условиях. Как сделать левитирующий магнит своими руками. Применение магнитов в подшипниках. Как используют магнитную левитацию в ветрогенераторах….
08 11 2019 13:47:40
Контурные токи: калькулятор расчета, примеры применения метода
Определение и суть метода контурных токов. Контурные токи: особенности метода. Разновидности контурного представления. Пример расчета сложных цепей. Преимущества М К Т. Использование планарных графов и метод выделения максимального дерева….
31 10 2019 7:43:27
Формула активного сопротивления в цепи переменного тока
Сопротивление с активным свойством в цепи переменного тока. Характеристики потерь. Формула активного сопротивления в цепи переменного тока. Треугольник сопротивлений. Особенности реактивного сопротивления….
19 10 2019 20:38:55
Монтаж встраиваемых и выдвижных розетки
Функционал места жительства сейчас на первом месте, именно поэтому стоит установить у себя выдвижные розетки их разновидности поражают воображение….
15 10 2019 17:22:58
Электротехника: основы, понятия, положения и определения
Основные понятия электротехники. Круг вопросов, рассматриваемых в большинстве курсов по электротехнике. Определения электромагнетизма, переменного тока и электрических машин (электродвигатели и генераторы)….
09 10 2019 21:16:53
Виды переключателей фаз -механический, ручной и трехфазный
Принцип работы и устройство фазового переключателя. Правила выбора переключателя фаз. Использование фазового переключателя для постоянного функционирования техники. Виды переключателей фаз -механический, ручной и трехфазный: какой переключатель фаз выбрать — механический или электронный….
06 10 2019 14:38:37
Источник: https://flatora.ru/electro/8969.php
ПОИСК
В металлургии электролиз применяют для полученпя и очистки металлов. Например, электролизом водных растворов солей получают цинк, кадмий, марганец, никель, олово, железо. Этот метод широко используют для получения металлов высокой степени чистоты путем электролитической очистки технических металлов.
Электролизом расплавов соединений получают алюминий, магний, натрий, кальций и другие металлы. [c.215] Электрохимическое выделение металлов из водных растворов их соединений лежит в основе гидроэлектрометаллургических процессов, т. е.
процессов извлечения металлов из руд (электроэкстракция) и их очистки (рафинирование) при помощи электролиза. Гидроэлектрометаллургическим путем получают и очищают такие металлы, как медь, никель, цинк, кадмий, олово, свинец, серебро, золото, марганец и др. Гидроэлектрометаллургия позволяет получать [c.
452]
Электрохимия имеет очень больщое значение, так как закономерности электрохимии являются теоретической основой для разработки важных технических процессов — электролиза и электросинтеза, т. е.
получения химических продуктов на электродах прн прохождении тока через растворы (получение хлора и щелочей, получение и очистка цветных и редких металлов, электросинтез органических соединений). Важной областью практического применения электролиза является гальванотехника (электропокрытие металлами и получение металлических матриц).
Другая важная область техники, в основе которой лежат электрохимические процессы, — это создание химических источников тока (электрохимических или так называемых гальванических элементов, в том числе аккумуляторов), в которых [c.383]
В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др. [c.181]
Электрометаллургия — техническое получение или очистка металлов путем электролиза при обычных температурах, электролиза расплавов или плавления металлов за счет использования теплоты электрического тока. [c.157]
ЭЛЕКТРОМЕТАЛЛУРГИЯ — получение или очистка металлов путем электролиза растворов или расплавов, плавления металлов за счет использования теплоты электрического тока. [c.290]
Плавка под слоем щелочи. Полученную в процессе цементации или электролиза губку индия переплавляют под слоем расплавленного едкого натра.
Этим достигается, помимо получения компактного металла, очистка от большей части цинка или алюминия, на которых производилась цементация, а также от ряда других примесей, растворяющихся в расплавленной щелочи.
Вместо переплавки под щелочью иногда применяют плавку под глицерином с добавкой хлорида аммония. При этом содержание примесей цинка, кадмия и железа может быть снижено до десятитысячных долей процента [111]. [c.318]
Получение цинка высокой чистоты. Цинк марки ЦВ, содержащий 99,99% Zn, получают дистилляцией катодных металлов. Для получения цинка еще более высокой чистоты (99,999% ) разработан метод перечистки электролитический металл растворяют химически или анодно. При химическом растворении полученные электролиты подвергают глубокой очистке, электролиз проводят в электролизере с диафрагмой и с нерастворимыми анодами. При анодном растворении осуществляют двухстадийную очистку вначале проводят анодное растворение обычного промышленного металла и его катодное осаждение, а затем повторное переосаждение полученного металла. [c.391]
Металлический натрий — далеко не единственный металл, вырабатываемый электрохимическим путем.
Практическое использование электрохимии для получения или очистки металлов, так называемая электрометаллургия, — это огромная отрасль промышленности, которая в свою очередь распадается на электроэкстракцию металлов из водных растворов их солей, на рафинирование (очистку) металлов путем электролиза и на электролиз расплавленных соединений. [c.31]
Основная алюминиевая руда — боксит — смесь гидратированных окислов алюминия [АШОг, А1(0Н)з]. Из этой руды металл получают электролизом (описание процесса см. в гл. ХП1), и иногда такой металл подвергают дальнейшей электролитической очистке. [c.117]
Очень часто восстановление металла осложняется сопутствующим ему восстановлением других металлов (примесей) или водорода. Это явление имеет большое практическое значение.
Вопросы электролитической рафинировки металлов (очистка от примесей), вопросы гальваностегии и многие Другие связаны с проблемой одновременного восстановления нескольких различных катионов.
В качестве примера можно привести электролиз водных растворов солей цинка выделению цинка на катоде непременно сопутствует выделение водорода. [c.520]
В штате Невада (США) работала большая опытная установка для переработки окисленных цинковых руд щелочным способом. Руда при сильном перемешивании выщелачивалась отработанным электролитом кроме цинка, в раствор переходят карбонаты и силикаты натрия, которые затем удаляются обработкой известью.
От меди, свинца и некоторых других металлов очистка производится цементацией цинковой пылью. Электролиз ведут в открытой ванне. Катоды — из магния или из нержавеющей стали, аноды — никелированная сталь. Плотность тока — 500—2700 а/ж , ниже 500 а/м выход цинка по току падает ниже 90%. Концентрация цинка в [c.
301]
Плавка под слоем щелочи. Полученная в процессе цементации или электролиза губка индия переплавляется под слоем расплавленного едкого натра. Этим достигается, помимо получения компактного металла, очистка от большей части цинка или алюминия, на которых производилась цементация, а также ряда других примесей, растворяющихся в расплавленной щелочи. [c.200]
Металлы и другие вещества часто получают электролизом. При пропускании через расплавы солей металлов главной подгруппы второй группы постоянного электрического тока выделяются чистые металлы. Щелочные металлы получают электролизом расплавленных щелочей и солей этих металлов.
Раствор солей Na l и Na lO, обладающий белящими свойствами, образуется при электролизе водного раствора поваренной соли. Широко распространен электролитический метод очистки металлов. Так, например, очищают (рафинируют) медь для нужд электротехнической промышленности.
С этой целью так называемую сырую медь, т. е. медь, содержащую различные примеси, берут в качестве анода. Катодом же служит пластинка из чистой меди. Оба электрода погружаются в раствор сульфата меди.
При пропускании постоянного электрического тока происходит выделение чистой меди на катоде и растворение анода [c.234]
Металл, полученный электролизом, содержит 98,5—99,8% алюминия. Алюминий-сырец подвергают электролитическому рафинированию (очистке), в результате чего получается алюминий 99,9%-ной чистоты. [c.189]
Химический процесс, происходящий при пропускании электрического тока через раствор электролита или через расплавленный электролит, называется электролизом.
Активные металлы получаются электролизом расплавленных солей или щелочей. Кроме получения металлов из соединений, электролизом пользуются для очистки многих металлов от примесей.
Электрохимическим путем получают очень чистые металлы. [c.396]
Штейн также очищается методами гидрометаллургии с использованием двух основных способов выщелачивания — серной кислотой или хлоридами в обоих случаях металл извлекается электролизом.
Процесс с применением хлоридов включает очистку с помощью растворителей и (или) ионообменных смол, а также удаление сульфатов хлоридом бария.
И в этом случае эффективность процесса может быть значительно повышена с помощью дополнительной очистки — фильтрования через песок, а при экстракции растворителем — коалесценцией и (или) адсорбцией на активном угле. [c.131]
Одним из наиболее удобных методов отделения кобальта и никеля от щелочных и щелочноземельных металлов является электролиз с ртутным катодом. Но в слз чае, когда количество никеля и кобальта велико, выделение металла продолжается довольно долго, иногда бывает не совсем полным, и, кроме того, создается необходимость очистки больших количеств ртути. [c.82]
Сплавы ванадия. Ванадия содерхсится в земной коре больше, чем других металлов. Как основа коррозионностойких сплавов ванадий — перспективный металл. Однако его коррозионная стойкость ниже, чем остальных тугоплавких металлов (Та, ЫЬ, Мо).
Поэтому целью легирования ванадия является, в частности, повышение коррозионной стойкости.
Ванадий (в виде феррованадия) применяется в черной металлургии как легирующий элемент, ()аскислитель и модификатор, и невысокая чистота ванадия по таким примесям, как О, Ы, С, Ре, 81, не является препятствием для его использования по этому назначению.
Однако при использовании ванадия в качестве основы соответствующих сплавов содержание этих примесей имеет большое значение. Все указанные примеси ухудшают пластичность ванадия, и так называемый черновой ванадий, полученный методом восстановления из пятиокиси ванадия У Об, непластичен.
Его необходимо подвергать дополнительной очистке электролизом и вакуумным переплавом. Для изготовления опытных плавок бьш выбран ванадий, рафинированный электронно-лучевым переплавом (полупромышленного производства), трех сортов. В табл. 1 приведено среднее содержание примесей в скобках указан разброс результатов для различньгк образцов. [c.8]
В металлургической промышленности электролизом расплавленных соединений и водных растворов получают металлы, а также производят электролитическое рафинирование — очистку металлов от вредных примесей и извлечение ценных компонентов. [c.299]
Металлы достаточно высокой чистоты образуются при окислении технического металла с последующим восстановлением полученных соединений до исходного металла путем электролиза в расплавах или в растворах. Такой метод очистки называется методом электрорафии и р о в а н и я. [c.193]
Электролиз с использованием растворимых анодов из чернового металла (полученного пирометаллургическим способом) и осаждением на катоде металла повышенной чистоты носит название электролитического рафинирования.
Катодное осаждение металлов при электролизе растворов, полученных при выщелачивании руд (и г рошедших соответствующую очистку), называется электроэкстракцней.
Как видно из приводимого ниже материала, оба указанных метода нащли применение в современной гидроэлектрометаллургии. [c.247]
Поэтому понятно, что дистилляция и сублимация при высокой температуре почти всегда служат для получения или приготовления в чистом виде элементов или для удаления нежелательных летучих примесей.
Так удается, например, уже в течение нескольких секунд удалить прймеси Ре, 31, А1, Т1, V из угля, предназначенного для спектральных измерений путем их испарения при 2700° [56]. При получении графита Ачесона используют распад карбида кремния на графит и пары 51, происходящий при —2200°.
Металлы, полученные электролизом или восстановлением, бывают загрязнены водородом или летучими щелочными металлами. Отделение этих примесей можно часто осуществить нагреванием металлов в высоком вакууме. Иногда этот метод может служить также для удаления азота или кислорода.
Обезгаживание или очистку высокоплавких металлов, таких, как W, Мо, Та, в вакууме при высокочастотном обогреве проводят в большом масштабе при производстве радиоламп [57]. Об испарении металлов в высоком вакууме см. [58]. [c.564]
Исключительно эффективным является способ окисления примесей в ртути с помощью озона, предложенный Н. Н. Роза-новы1м25. Им было устзновлено, что озонирование ртути в течение 16 мин. дает такой же эффект очистки от неблагородных. металлов, как электролиз ртути в течение [c.8]
Кюн и Херинг [140] разработали метод очистки солей щелочных и щелочноземельных металлов для электролиза обработкой их хело-новыми смолами. [c.30]
На конечном этапе получения кобальта и никеля оксиды (смесь СоО и С02О3 в производстве Со и N 0 в производстве N1) восстанавливают углеродом в электропечах. Выплавленные кобальт и никель очищают электролизом (электролиты — водные растворы Со504 или N 504 с добавками).
Никель отделяют часто от других металлов в виде карбонила Ni( 0)4l. Сопутствующая никелю медь кар нила не образует, а карбонилы Сог(СО)8] и Ре(С0)5] сильно отличаются по давлению пара от [N (00)4].
Для отделения никеля полученный восстановлением оксидов высокодисперсный продукт, содержащий N1, Со, Ре, Си и различные примеси, обрабатывают СО при давлении 7-20 МПа и температуре 200 С.
Образовавшийся карбонил никеля очищают методом ректификации, затем разлагают при нагревании до 200 С при атмосферном давлении на N1 и СО. Этим способом получают никель высокой чистоты (до 99,99%), который не требует очистки электролизом. [c.531]
Селен. Селен был открыт шведским химиком Берцелиусом в 1817 году. Он содержится в дыме, образующемся при горении пирита в процессе производства серной кислоты, а также в отстоях электролитических ванн после процесса очистки металлов путем электролиза. Селеп можно получить в красной аморфной форме восстановлением селеновой кислоты.
Наиболее устойчивая серая металлическая форма образуется из аморфной в результате нагревания в определенных регулируемых условиях. По своим аллотропным формам, по типам соединений и их реакциям селен сходен с серой. Так, селенистый водород НгЗе представляет собой газ, запах которого еще более устойчив и неприятен, чем запах сероводорода. [c.
181]
Электролизом растворов соединений можгю получить водород и простые вещества большинства -элементов, таких, как 2п, Си, N1, Со и др.
Электрохимическое восстановление используется также для рафинирования (очистки) сырых металлов (Сг, N1, 2п, Ag, 5п), полученных другими способами.
При электролитическом рафинировании в качестве анода используется сырой металл, в качестве электролита берется соответствующее соединение данного элемента. [c.245]
Электролитическое выделение металла из раствора называется э л е к т р о э к с т р а к ц и е й. Руда или обогащенная руда — концентрат (см.
192)—подвергается обработке определенными реагентами, в результате которой металл переходит в раствор. После очистки от примесей раствор направляют на электролиз.
Металл выделяется на катоде и в большпиствс случаев характеризуется высокой чистотой. Этим методом получают главным образом цинк, медь и кадмии. [c.300]
При проведении электролиза в промышленных масшт 1бах требуется очень много электроэнергии, что делает этот метод дорогим, хотя и эффективным способом получения и очистки металлов. Используемый в настоящее время промышленный метод очистки меди основан на электрометаллургической очистке металла, полученного пирометаллургическим способом. [c.154]
Аналогично получают металлический Th. При восстановлении Thp4 кальцием металл выделяется в виде губчатой массы.
Проводят также электролиз расплавов, содержащих Thp4 или К [ThFs] и хлориды щелочных металлов. Процесс ведут при 750—800 °С. Глубокую очистку Th осуществляют иодидным методом (см. разд. 8.2).
Плутоний образуется в ядерных реакторах из при захвате им нейтронов [c.608]
Источник: https://www.chem21.info/info/16580/