Кислород как химический элемент — Ида Тен

Кислород – химический элемент, свойства которого будут рассмотрены в следующих нескольких параграфах. Обратимся к Периодической Системе химических элементов Д.И. Менделеева. Элемент кислород расположен во 2 периоде, VI группе, главной подгруппе.
Там же указано, что относительная атомная масса кислорода равна 16.
По порядковому номеру кислорода в Периодической Системе можно легко определить количество электронов, содержащихся в его атоме, заряд ядра атома кислорода, количество протонов.
Валентность кислорода в большинстве соединений равна II. Атом кислорода может присоединять два электрона и превращаться в ион: O0 + 2ē = O−2.
Стоит отметить, что кислород – самый распространенный элемент на нашей планете. Кислород входит в состав воды. Морские и пресные воды на 89% по массе состоят из кислорода. Кислород входит в состав множества минералов и горных пород. Массовая доля кислорода в земной коре составляет около 47%. В воздухе кислорода содержится около 23% по массе.
Физические свойства кислорода
При взаимодействии двух атомов кислорода образуется устойчивая молекула простого вещества кислорода O2. Данное простое вещество, как и элемент, называется кислородом. Не путайте кислород-элемент, и кислород – простое вещество!
По физическим свойствам кислород – бесцветный газ без запаха и вкуса. Практически нерастворим в воде (при комнатной температуре и нормальном атмосферном давлении растворимость кислорода составляет около 8 мг на один литр воды).
Кислород растворим в воде – в 1 л воды при температуре 20°С растворяется 31 мл кислорода (0,004% по массе). Однако этого количества достаточно для дыхания рыб, живущих в водоемах. Газообразный кислород немного тяжелее воздуха: 1 л воздуха при температуре 0°С и обычном давлении весит 1,29 г, а 1 л кислорода – 1,43 г.
Кислород проявляет интересные свойства при сильном охлаждении. Так, при температуре –183°С кислород конденсируется в прозрачную подвижную жидкость бледно- голубого цвета.
Если жидкий кислород охладить еще сильнее, то при температуре –218°С кислород «замерзает» в виде синих кристаллов.
Если температуру постепенно повышать, то при –218°С, твердый кислород начнет плавится, а при –183°С – закипит.
Следовательно, температуры кипения и конденсации, а также температуры замерзания и плавления для веществ являются одинаковыми.
Для хранения и транспортировки жидкого кислорода используют так называемые сосуды Дьюара. Сосуды Дьюара используют для хранения и транспортировки жидкостей, температура которых должна длительное время оставаться постоянной. Сосуд Дьюара носит имя его изобретателя, шотландского физика и химика Джеймса Дьюара.
Простейшим сосудом Дьюара является бытовой термос. Устройство сосуда довольно простое: это колба, помещенная в большую колбу. Из герметичного пространства между колбами откачивается воздух. Благодаря отсутствию воздуха между стенками колб, жидкость, налитая во внутреннюю колбу, долгое время не остывает или не нагревается.
Кислород — парамагнитное вещество, то есть в жидком и твердом состояниях он притягивается магнитом
В природе существует еще одно простое вещество, состоящее из атомов кислорода. Это озон. Химическая формула озона О3. Озон, так же как и кислород, в обычных условиях – газ. Озон образуется в атмосфере во время грозовых разрядов. Характерный запах свежести после грозы является запахом озона.
Если озон получить в лаборатории и собрать значительное количество его, то в больших концентрациях озон будет иметь резкий неприятный запах. Получают озон в лаборатории в специальных приборах – озонаторах. Озонатор – стеклянная трубка, в которую подают ток кислорода, и создают электрический разряд. Электрический разряд превращает кислород в озон:
В отличие от бесцветного кислорода, озон – газ голубого цвета. Растворимость озона в воде составляет около 0,5 л газа на 1 литр воды, что значительно больше, чем у кислорода. С учетом этого свойства озон применяется для обеззараживания питьевой воды, так как оказывает губительное действие на болезнетворные микроорганизмы.
При низких температурах, озон ведет себя аналогично кислороду. При температуре –112°С он конденсируется в жидкость фиолетового цвета, а при температуре –197°С кристаллизуется в виде темно-фиолетовых, почти черных кристаллов
Таким образом, можно сделать вывод, что атомы одного и того же химического элемента могут образовывать разные простые вещества.
Явление существования химического элемента в виде нескольких простых веществ называется аллотропией.
Простые вещества, образованные одним и тем же элементом, называют аллотропными модификациями
Значит, кислород и озон – аллотропные модификации химического элемента кислорода. Существуют данные, что при сверхнизких температурах, в жидком или твердом состоянии кислород может существовать в виде молекул О4 и О8.
Круговорот кислорода в природе
Количество кислорода в атмосфере постоянно. Следовательно, расходующийся кислород постоянно пополняется новым.
Важнейшими источниками кислорода в природе является углекислый газ и вода. Кислород попадает в атмосферу главным образом в результате процесса фотосинтеза, протекающего в растениях, согласно схеме реакции:
CO2 + H2O → C6H12O6 + O2.
Кислород может образовываться и в верхних слоях атмосферы Земли: вследствие воздействия солнечного излучения, водяные пары частично разлагаются с образованием кислорода.
Кислород расходуется при дыхании, сжигании топлива, окислении различных веществ в живых организмах, окислении неорганических веществ, содержащихся в природе. Большое количество кислорода расходуется в технологических процессах, таких как, например, выплавка стали.
Круговорот кислорода в природе можно представить в виде схемы:
- Кислород – элемент VI группы, главной подгруппы, 2 периода Периодической Системы Д.И. Менделеева
- Элемент кислород образует в природе две аллотропные модификации: кислород О2 и озон О3
- Явление существования химического элемента в виде нескольких простых веществ называется аллотропией
- Простые вещества называют аллотропными модификациями
- Кислород и озон имеют различные физические свойства
- Кислород – бесцветный газ без запаха, вкуса, практически не растворим в воде, при температуре –183°С конденсируется в бледно-голубую жидкость. При температуре –218°С кристаллизуется в виде кристаллов синего цвета
- Озон – газ синего цвета с резким неприятным запахом. Хорошо растворим в воде. При температуре –112°С конденсируется в фиолетовую жидкость, кристаллизуется в виде темно-фиолетовых, почти черных кристаллов, при температуре –197°С
- Жидкий кислород, озон и другие газы хранят в сосудах Дьюара
Источник: https://idatenru.ru/chemistry/kislorod-kak-himicheskii-element
Кислород газ. Свойства, добыча, применение и цена кислорода

Ком в горле — это кислород. Выяснено, что в состоянии стресса у человека расширяется голосовая щель. Она находится посредине гортани, ограничена 2-мя мышечными складками.
Они-то и давят на близлежащие ткани, создавая ощущение кома в горле. Расширение щели – следствие повышенного потребления кислорода. Он помогает справиться со стрессом. Так что, пресловутый ком в горле можно назвать кислородным.
8-ой элемент таблицы Менделеева привычен в форме газа. Но, бывает и жидкий кислород. Элемент в таком состоянии магнитится. Впрочем, о свойствах кислорода и плюсах, которые из них можно извлечь, поговорим в основной части статьи.
Свойства кислорода
За счет магнитных свойств жидкий кислород перемещают с помощью мощных магнитов. Если же говорить об элементе в привычном состоянии, он сам способен перемещать, в частности, электроны.
Собственно, на окислительно-восстановительном потенциале вещества строится система дыхания человека. Кислород в ней – конечный акцептор, то есть принимающий агент.
Донорами выступают ферменты. Вещества, окисленные кислородом, выделяются во внешнюю среду. Это углекислый газ. В час его вырабатывается от 5-ти до 18-ти литров.
Еще 50 граммов выходит воды. Так что обильное питье – обоснованная рекомендация медиков. Плюсом, побочными продуктами дыхания служат около 400-от веществ. Среди них есть ацетон. Его выделение усиливается при ряде заболеваний, к примеру, сахарном диабете.
В процессе дыхания участвует обычная модификация кислорода – О2. Это двухатомная молекула. В ней 2 неспаренных электрона. Оба находятся на разрыхляющих орбиталях.
На них больший энергетический заряд чем на связывающих. Поэтому, молекула кислорода легко распадается на атомы. Энергия диссоциации доходит почти до 500-от килоджоулей на моль.
В естественных условиях кислород – газ с почти инертными молекулами. В них сильная межатомная связь. Процессы окисления протекают едва заметно. Для ускорения реакций нужны катализаторы. В организме ими выступают ферменты. Они провоцируют образование радикалов, которые и возбуждают цепной процесс.
Катализатором химических реакций с кислородом может стать температура. 8-ой элемент реагирует даже на небольшой нагрев. Жар дает реакции с водородом, метаном и прочими горючими газами.
Взаимодействия протекают со взрывами. Не зря же взорвался один из первых в истории человечества дирижаблей. Он наполнялся водородом. Воздушное судно звалось «Гинденбург», крушение потерпело в 1937-ом.
Нагрев позволяет кислороду создавать связи со всеми элементами таблицы Менделеева, кроме инертных газов, то есть аргона, неона и гелия. Кстати, гелий стал заменой для наполнения дирижаблей.
В реакции газ не вступает, только вот стоит дорого. Но, вернемся к герою статьи. Кислород – химический элемент, взаимодействующий с металлами уже при комнатной температуре.
Ее же достаточно для контакта с некоторыми сложными соединениями. К последним относятся оксиды азота. А вот с простым азотом химический элемент кислород реагирует лишь при 1 200-от градусах Цельсия.
Для реакций героя статьи с неметаллами нужен нагрев хотя бы до 60-ти градусов Цельсия. Этого достаточно, к примеру, для контакта с фосфором. С серой герой статьи взаимодействует уже при 250-ти градусах. Кстати, сера входит в элементы подгруппы кислорода. Она главная в 6-ой группе таблицы Менделеева.
С углеродом кислород взаимодействует при 700-800-от градусах Цельсия. Имеется в виду окисление графита. Этот минерал – одна из кристаллических форм углерода.
Кстати, окисление – роль кислорода в любых реакциях. Большинство из них протекает с выделением света и тепла. Попросту говоря, взаимодействие веществ приводит к горению.
Биологическая активность кислорода обусловлена растворимостью в воде. При комнатной температуре в ней диссоциируют 3 миллилитра 8-го вещества. Расчет ведется на 100 миллилитров воды.
Большие показатели элемент показывает в этаноле и ацетоне. В них растворяются 22 грамма кислорода. Максимальная же диссоциация наблюдается в жидкостях, содержащих фтор, к примеру, перфторбутитетрагидрофуране. На 100 его миллилитров растворяются почти 50 граммов 8-го элемента.
Говоря о растворенном кислороде, упомянем его изотопы. Атмосферному причислен 160-ый номер. Его в воздухе 99,7%. 0,3% приходятся на изотопы 170 и 180. Их молекулы тяжелее.
Связываясь с ними, вода с трудом переходит в парообразное состояние. Вот в воздух и поднимается лишь 160-я модификация 8-го элемента. Тяжелые изотопы остаются в морях и океанах.
Интересно, что кроме газообразного и жидкого состояний, кислород бывает твердым. Он, как и жидкая версия, образуется при минусовых температурах. Для водянистого кислорода нужны -182 градуса, а для каменного минимум-223.
Последняя температура дает кубическую решетку кристаллов. От -229-ти до -249-ти градусов Цельсия кристаллическая структура кислорода уже гексагональная. Искусственно получены и прочие модификации. Но, для них кроме пониженных температур требуется повышенное давление.
В привычном состоянии кислород относится к элементам с 2-мя атомами, не имеет цвета и запаха. Однако, существует 3-атомная разновидность героя статьи. Это озон.
У него появляется выражено свежий аромат. Он приятен, но токсичен. Отличием от обычного кислорода является, так же, большая масса молекул. Атомы сходятся воедино при грозовых разрядах.
Поэтому, запах озона чувствуется после ливней. Чувствуется аромат и на больших высотах в 10-30 километров. Там образование озона провоцирует ультрафиолет. Атомы кислорода захватывают излучение солнца, соединяясь в крупные молекулы. Это, собственно, уберегает человечество от радиации.
Добыча кислорода
Промышленники добывают героя статьи из воздуха. Его очищают от паров воды, угарного газа и пыли. Затем, воздух сжижают. После очистки остается лишь азот и кислород. Первый испаряется при -192-ух градусах.
Кислород остается. Но, российские ученые обнаружили кладезь уже сжиженного элемента. Находится он в мантии Земли. Ее еще называют геосферой. Расположен слой под твердой корой планеты и над ее ядром.
Установить там знак элемента кислород помог лазерный пресс. Работали с ним в синхротронном центре DESY. Он находится в Германии. Изыскания проводились совместно с немецкими учеными. Вместе же подсчитали, что содержание кислорода в предполагаемой прослойке мании в 8-10 раз больше, чем в атмосфере.
Уточним практику вычисления глубинных рек кислорода. Физики работали с оксидом железа. Сдавливая и нагревая его, ученые получали все новые оксиды металла, неизвестные ранее.
Когда дело дошло до тысячеградусных температур и давления, превышающего атмосферное в 670 000 раз, получилось соединение Fe25O32. Описаны условия срединных слоев геосферы.
Реакция преобразования оксидов идет с глобальным выбросом кислорода. Следует предполагать, что тоже происходит внутри планеты. Железо – типичный для мантии элемент.
Соединение элемента с кислородом тоже типично. Нетипична версия, что атмосферный газ – просочившийся за миллионы лет из-под земли и накопившийся у ее поверхности.
Грубо говоря, ученые поставили под сомнение главенствующую роль растений в образовании кислорода. Зелень может давать лишь часть газа. В этом случае бояться нужно не только уничтожения флоры, но и остывания ядра планеты.
Снижение температуры мантии может блокировать процесс образования кислорода. Массовая доля его в атмосфере тоже пойдет на спад, а вместе с тем и жизнь на планете.
Вопрос, как добывать кислород из мании, не стоит. Пробурить землю на глубину свыше 7 000-8 000 километров невозможно. Остается ждать пока герой статьи просочиться к поверхности сам и извлекать его из атмосферы.
Применение кислорода
Активно применять кислород в промышленности начали с изобретением турбодетандеров. Они появились в середине прошлого века. Устройства сжижают воздух и разделяют его. Собственно, это установки для добычи кислорода.
Какими элементами образован круг «общения» героя статьи? Во-первых, это металлы. Речь не о прямом взаимодействии, а о расплавлении элементов. Кислород добавляют в горелки для максимально эффективного сжигания топлива.
В итоге, металлы быстрее размягчаются, смешиваясь в сплавы. Без кислорода, к примеру, не обходится конвекторный способ производства стали. Обычный воздух в качестве розжига малоэффективен. Не обходится без сжиженного газа в баллонах и резка металлов.
Кислород как химический элемент был открыт и фермерами. В сжиженном виде вещество попадает в коктейли для животных. Они активно прибавляют в весе. Связь между кислородом и массой животных прослеживается в Каменноугольном периоде развития Земли.
Эра отмечена жарким климатом, обилием растений, а следовательно, и 8-го газа. В итоге, по планете ползали сороконожки под 3 метра длиной. Найдены окаменелости насекомых. Схема работает и в современности. Дай животному постоянную добавку к привычной порции кислорода, получишь наращивание биологической массы.
Медики запасаются кислородом в баллонах для купирования, то есть остановки приступов астмы. Газ нужен и при устранении гипоксии. Так именуют кислородное голодание. Помогает 8-ой элемент, так же, при недугах желудочно-кишечного тракта.
В этом случае лекарством становятся кислородные коктейли. В остальных случаях вещество подают пациентам в прорезиненных подушках, или через специальные трубки и маски.
В химической промышленности герой статьи – окислитель. О реакциях, в кторых может участвовать 8-ой элемент, уже говорилось. Характеристика кислорода положительно рассмотрена, к примеру, в ракетостроении.
Героя статьи выбрали окислителем топлива кораблей. Самой мощной окислительной смесью признано соединение обеих модификаций 8-го элемента. То есть, ракетное топливо взаимодействует с обычным кислородом и озоном.
Цена кислорода
Героя статьи продают в баллонах. Они обеспечивают связь элемента. С кислородом можно приобрести баллоны в 5, 10, 20, 40, 50 литров. В общем, стандартен шаг между объемами тар в 5-10 литров. Разброс цен на 40-литровый вариант, к примеру, от 3 000 до 8 500 рублей.
Рядом с высокими ценниками, как правило, стоит указание соблюденного ГОСТа. Его номер – «949-73». В объявлениях с бюджетной стоимостью баллонов ГОСТ прописан редко, что настораживает.
Транспортировка кислорода в баллонах
Если же говорить в философском плане, кислород бесценен. Элемент является основой жизни. По организму человека кислород транспортирует железо. Связка элементов зовется гемоглобином. Его нехватка – анемия.
Заболевание имеет серьезные последствия. Первое из них – снижение иммунитета. Интересно, что у некоторых животных кислород крови переносится не железом. У мечехвостов, к примеру, доставку 8-го элемента к органам осуществляет медь.
Источник: https://tvoi-uvelirr.ru/kislorod-gaz-svojstva-dobycha-primenenie-i-cena-kisloroda/
Кислород

Кислоро́д — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов, с атомным номером 8. Обозначается символом O (лат. Oxygenium).
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород.
Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
2HgO (t) → 2Hg + O2↑ Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А.
Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах. Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота.
Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида. Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле.
Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В.
Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч.
ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Получение
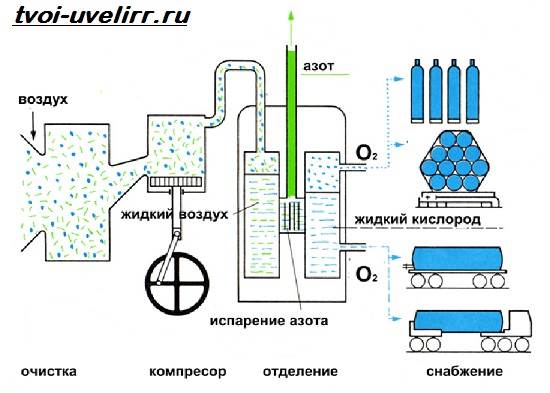
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
также используют реакцию каталитического разложения пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей.
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C).
Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком. При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %. Жидкий кислород (темп.
кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (темп. плавления −218,79 °C) — синие кристаллы.
Источник: Википедия
Другие заметки по химии
Источник: https://edu.glavsprav.ru/info/o
Кислород
(Oxygenium), О — химический элемент. Элемент VI группы периодична системы элементов; ат. н. 8 ат м 15, 9994 В норм, условиях — газ без цвета, запаха и вкуса. При образовании большинства соединении приобретает электроны, В окислах (напр.
,Н2O, Li2O, СаО, Аl2O3, SiO2, Р2O6, SO3, Сl2O7), кислородных к-тах и их солях К.
проявляет формально степень окисления — 2, в пероксосоединениях (Н2O2, Na2O2, Ва2O2) есть кислородный перекисный мостик — О⁻ — О⁻ — с межъядерным расстоянием 1,48 А, в надперекисях (КO2, Rb02 Gs02) содержится группа 0—2 с межъядерным расстоянием 1,26 А, в озонидах (КO3, RbO3, CsO3) — парамагнитный анион 0- 3.
Рис. Горение натрия. Горение угля Горение железа в кислороде.
Только в соединениях с фтором (F20, F202) и в солях диоксигенил-катиона. напр. гексафтороплатинате (+ 5) диоксигенила 02 [PtF6], К. проявляет степень окисления + 1. Природный К.
состоит из стабильных изотопов 16О (99,759%), 17О (0,037%) и 18О (0,204%); получены радиоактивные изотопы 14О, 15О и 19О с периодами полураспада соответственно 72,1 сек, 2,1 мин и 29,4 сек. Открыли К. швед, химик К. В.
Шееле — в 1771 (работы его опубликованы в 1777) и независимо от него англ. ученый Дж. Пристли — в 1774. Франц. химик А. Л. Лавуазье повторил опыты Дж.
Пристли (термическое разложение окиси ртути), дал элементу название и к 1777 создал кислородную теорию горения, дыхания и окисления, п.- самый распространенный в земной коре элемент: содержание его составляет 47,0% по массе, или 55 ат.%.
В форме газа O2 в воздухе находится 1,2« 104 т К., что составляет 20,95 об.%, или 23% по массе. В нижних слоях стратосферы содержится очень небольшое количество озона O3, образующегося под действием ультрафиолетового излучения Солнца, а выше 80 км — атомы К.
, образующиеся вследствие распада молекул O2, O3 и водяного пара под действием коротковолнового излучения. К. в воде — 88,8%, в водах мирового океана — 85,7%; в природных водах растворено около 1,5• 10 13 m К. Из минералов, содержащих К. (их около 1400), наиболее распространены кварц и его модификации (53% К.
), полевые шпаты, слюды и известняки (45—48%), окислы железа (28—43%), гипс и глины (около 55%).
Кислород образует два простых вещества: К.-газ и озон О3. При высоких давлениях возможно образование молекул O4. К.— трудно сжижающийся газ. Осн.
термодинамические параметры — критическая точка: т-ра 154,8 К (—118,4° С); давление 50,14 ат; плотность 0,406 г/см3; тройная точка: температура 54,36 К (—218,8° С); давление 1,54 • 10-3 am. Т-ра кипения 90,18 К (—182,97° С) при давлении 760 мм рт. ст.
, теплота испарения 51,0 ккал/кг; плотность жидкого К. (т-ра 90,18 К) 1,142 г/см3. Т-ра плавления 54,36 К (—218,8° С); теплота плавления 3,3 ккал/кг. Кристаллич.
модификации: кубическая, устойчивая выше т-ры 43,77 К (—229,4° С), с плотностью 1,27 г/см3 при т-ре —219° С; гексагональная, устойчивая от 23,85 К (—249,3° С) до 43,77 К, и ромбическая, устойчивая при т-ре ниже 23,85 К, с плотностью 1,426 г/см3.
Жидкий кислород — светло-голубого цвета, притягивается магнитам; твердый К.— синие кристаллы. Во всех агрегатных состояниях парамагнитен. Диэлектрическая постоянная газа — 1,000507, жидкого К.— 1,491. Масса 1 а газа при т-ре 0° С и давлении 1 ат равна 1,42897 г/л, коэфф.
теплопроводности 58,3 • 10-6 кал/сек • см • град; теплоемкость Ср = 6,99 и cv = 4,98 кал/моль • град; cp/cν = 1,403. Растворимость К. в воде (в 100 см3) при т-ре 0°С составляет 4,9 см3, при т-ре 20° С равна 3,1 см3. К.
хорошо растворяется в органических растворителях и затвердевании расплава, разбрызгивая металл; хорошо поглощается также тонкими порошками металлов и угля. Молекула О2 очень прочна(межъядерное расстояние 1,207 А), распад ее на атомы начинается выше т-ры 1500° С и становится полным при т-ре 5000° С. Энергия атомизации D298 = 119,12 ккал/моль.
Под действием ультрафиолетового излучения (А, — 190 нм) легко осуществляется фотолиз кислорода. Перем. степень окисления К., способность к принятию электронов от атомов др.
элементов (сродство к электрону 1,47 эв/атом) и возможность отдачи своего электрона (1-й потенциал ионизации—13,6 в, электроотрицательность по шкале Полинга 3,5) обусловливают возможность образования твердых растворов в металлах и различного рода стехиометрических и нестехиометрических соединений. К. образует соединения со всеми элементами, кроме гелия, неона и аргона.
На основе типов и св-в кислородных соединений строится классификация неорганических соединений. Увеличение содержания К. в молекуле окисла усиливает кислотный характер этого окисла, напр. МnО проявляет Основные св-ва, а Мn2O7 является ангидридом марганцевой (перманганатной) кислоты НМn04.
При обычных условиях взаимодействие с К. веществ, способных его присоединять, протекает в большинстве случаев медленно; при нагревании, под действием тихого или искрового электр. разряда, под давлением и при наличии катализатора скорость реакции значительно возрастает.
Катализатором для очень многих реакций с К. является вода; абсолютно сухой К. при комнатной т-ре не взаимодействует с металлическим калием, с белым фосфором.Большинство реакций К.
с различными веществами экзотермичны; некоторые из них используются для получения энергии в форме тепла и света (горение): в процессе сжигания угля, различных углеводородов, древесины, торфа и др. В смеси с горючими газами и парами, с тонкими порошками мн. металлов и органических веществ К.
-газ образует взрывчатые смеси. К. непосредственно реагирует почти со всеми простыми веществами за исключением галогенов, инертных газов, платины и золота, соединения с к-рыми получаются косвенным путем.
В лабораторных условиях К. получают термическим разложением окислов (напр., СrO3), перекисей (напр., ВаO2), солей кислородных кислот (напр., КМn04), каталитическим разложением Н2O2, электролизом 30%-ного раствора калия гидроокиси с никелевыми электродами.
В пром-сти К. получают фракционированной перегонкой жидкого воздуха, а также как побочный продукт при получении водорода электролизом воды. К.
можно получать также из воздуха избирательной диффузией при повышенном давлении через пластмассовые мембраны (молекулярные сита).
Выпускают Кислород как газ технический, технологический, медицинский и жидкий технический. Газообразный технический К. первого сорта содержит O2 не менее 99,7%, второго сорта — не менее 99,5%, третьего сорта — не менее 99,2%, технологический — не менее 95—98,5%, медицинский — не менее 99,5%. Медицинский К.
не должен содержать воды, масла, окиси углерода, ацетилена, газообразных оснований и к-т, озона и др. газов-окислителей. Допускается наличие двуокиси углерода (смесь К. с 5—7% СO2 наз. «карбоген»). Из 1 кг жидкого К. образуется 0,75 м3 газа, из 1 л — 0,86 м3. К. применяется в черной и цветной металлургии, хим. пром-сти, машиностроении, энергетике и др.
областях для получения высоких т-р (порядка 2500—3000е С) и для интенсификации технологических процессов.
Замена воздуха кислородом снижает расход топлива и увеличивает производительность доменных мартеновских печей, вагранок, конверторов, электр. печей на 25 -30% и более, повышает качество выплавляемого металла. На выплавку 1 т чугуна расходуется К. около 1000 м33, на 1 т конверторной стали — около 80 ,на 1 т мартеновской стали — 15—25 м3.
В цветной металлургии на 1 т металла расходуется 10 000—30 000 м3 К. Большое количество К. используют для автогенной сварки и резки, для газификации твердого топлива в кипящем слое, для огневого бурения твердых горных пород и др. Жидкий К.— основа мощных взрывчатых веществ — оксиликвитов (пропитанных жидким К. пористых горючих материалов, напр.
древесных опилок); применяется в ракетных двигателях.
Кислород -газ без цвета , запаха и вкуса . Мало растворим в воде : в 100 объёмах воды при 20 °C. Растворяется около 3 объёмов кислорода . При нормальном давлении он сжижается при — 183°C. И затвердевает при — 219°C . В жидком и твёрдом состоянии имеет бледно – синюю окраску . Молекула кислорода — двухатомная , неполярная .
В промышленности кислород получают в основном фракционированной разгонкой жидкого воздуха . Его хранят и перевозят в стальных баллонах . В лаборатории его получают разложением соединений , богатых кислородом . Чаще всего для этого используют хлорат или перманганат калия (KMnO4) . Разложение KMnO4 происходит по реакции :
2KMnO4 = K2MnO4 +MnO2 + O2
Наиболее важным химическим свойством кислорода является его способность соединятся с большинством простых веществ с выделением теплоты и света . Чтобы вызвать горение веществ в кислороде , часто приходится нагревать их до определённой температуры — температуры воспламенения , так как при обычной температуре кислород является довольно инертным веществом .
Наряду с горением известны многочисленные процессы медленного окисления при участии кислорода : дыхание живых организмов , ржавение металлов , гниение , тление и т.д . Выделяющая при этом теплота рассеивается в окружающее пространство , но в определённых условиях она может скапливаться и тогда происходит воспламенение , так самовоспламеняются масляные тряпки ,влажное сено и т.д.
Все окислительные процессы протекают гораздо быстрее в чистом кислороде , чем на воздухе . Например , лучина тлеющая на воздухе , при внесении в сосуд с кислородом вспыхивает и ярко горит .
Кислород — самый распространённый элемент на нашей планете : он составляет 49% от массы земной коры , гидросферы и атмосферы вместе взятых . В воздухе находится около 21% ( об. ) или 23 ( масс. ) кислорода .
Кислород воздуха непрерывно расходуется при дыхании , в процессе горения , гниения и т.д.
Его количество в воздухе всё время пополняется на солнечном свету . Общее количество кислорода , выделяемых растениями в атмосферу в процессе питания , примерно в 6 раз больше чем потребляемого ими для дыхания .
Кислород весьма распространён в природе в виде соединений . Он входит в состав всех важнейших горных пород : гранитов , гнейсов , песка , сланцев и многих других .
В воде содержится 88,89% ( масс. ) кислорода . Доступная нам часть твёрдой земной коры содержит 47,3% ( масс. ) кислорода ( в виде оксидов и кислородных солей ) . Кислород как элемент входит в состав тела человека , животных и растений . Содержание кислорода в живых организмах составляет около 65% ( масс. )
велико значение кислорода в технике и промышленности . При сжигании горючих газов в специально сконструированных горелках в токе чистого кислорода , температура пламени резко повышается по сравнением с пламенем на воздухе . Пламя водорода , сжигаемого в токе кислорода , достигает 2000 градусов , а ацетилена — 3000 град….
Пламенем таких горючих газов пользуются для сварки и резки металлов , для плавления платины , кварца и других очень тугоплавких материалов . Жидкий кислород или жидкий воздух , сильно обогащённый кислородом , применяют для изготовления взрывчатых веществ ( оксиликвитов ) .
Последнее представляет смесь пористого угля или других горючих составляющих ( нефть , парафин , нафталин ) с жидким воздухом .
Жидкий воздух применяют , в частности , как одна из составляющих при заправки ракет . Кислород широко используют для интенсификации ряда процессов металлургической и химической промышленности . Большое значение в применении кислорода в специальных аппаратах , используемых экипажами самолётов , подводных лодок , горно — рудном деле , в медицине и т.д.
Лит.: Кислород. Справочник, т. 1—2. М., 1967—73; Глизманенко Д. Л. Получение кислорода. М., ; Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и жидкостей.
Статья на тему Кислород
Источник: https://znaesh-kak.com/x/o/kislorod
Продаем кислород технический в газовых баллонах. Описание, технические характеристики его и применение

Кислород в баллонах – является одним из наиболее востребованных видов технических газов. Он не токсичен, не горюч, не взрывоопасен, отличается сравнительно невысокой ценой.
Важно и то, что газообразный и жидкий кислород никогда не оказывает какого-либо вредного воздействия на окружающую среду.
В то же время он является сильным окислителем и обладает способностью усиливать процессы горения, кислород взрывается при взаимодействии с разного рода смазочными веществами.
Кислород (02) – представляет собой газ, содержащийся в атмосфере, составе около 20% от всей общей массы и объема. Он присутствует в виде элемента в воде, в организмах и почти во всех природных элементах на Земле. Кислород применятся в промышленности в большом направлении отраслей, от медицины и до тяжелой и металлургической промышленности.
С помощью разного кислородного оборудования, возможно, получить кислород в состоянии газа, или в качестве жидкости, а возможно и в твердом состоянии в виде не больших сине-белых кристаллов. Чаще всего и более востребованный кислород в виде газа, его получают, используя специальные криогенные установки, способные выделять из сжиженного воздуха атомы кислорода.
Данный процесс, имеющий масштабы целой промышленности называется — криогенной ректификацией. Множество компаний предлагают кислородное оборудование, с помощью которого получается чистый кислород, применяющийся в медицинских целях. Такое оборудование позволяет получить чистый кислород с дальнейшим его использованием в кислородных коктейлях или в кислородных подушках.
Использование кислорода в промышленности
Жидкий кислород – это агрегатное состояние кислорода, он получается в виде жидкости, выделяющей достаточно много тепловой энергии от соприкосновения с органическими веществами. Исходя из этого, жидкий кислород достаточно востребован, в ракетной и в космической промышленностях.
Для его хранения и перевозки используют специальное оборудование, оснащенное хорошей теплоизоляцией.
Лучше всего кислород транспортировать в газообразном состоянии, в этом случаи востребованы наиболее простые и дешевые кислородные оборудования для транспортировки и дальнейшего хранения, при этом совершенно не потребуется никакого специального оборудования предназначенного для перегона кислорода из жидкого состояния в газообразное.
Баллоны заправленные кислородом (О2), имеют синий цвет.
Источник: https://nvph.ru/kislorod-gaz
Химические свойства кислорода

Кислород вступает в соединения почти со всеми элементами периодической системы Менделеева.
Реакция соединения любого вещества с кислородом называется окислением.
Большинство таких реакций идет с выделением тепла. Если при реакции окисления одновременно с теплом выделяется свет, ее называют горением. Однако не всегда удается заметить выделяющиеся тепло и свет, так как в некоторых случаях окисление идет чрезвычайно медленно. Заметить тепловыделение удается тогда, когда реакция окисления происходит быстро.
В результате любого окисления — быстрого или медленного — в большинстве случаев образуются окислы: соединения металлов, углерода, серы, фосфора и других элементов с кислородом.
Вам, вероятно, не раз приходилось видеть, как перекрывают железные крыши. Перед тем как покрыть их новым железом, старое сбрасывают вниз. На землю вместе с железом падает бурая чешуя — ржавчина. Это гидрат окиси железа, который медленно, в течение нескольких лет, образовывался на железе под действием кислорода, влаги и углекислого газа.
Ржавчину можно рассматривать как соединение окиси железа с молекулой воды. Она имеет рыхлую структуру и не предохраняет железо от разрушения.
Для предохранения железа от разрушения — коррозии — его обычно покрывают краской или другими коррозионно устойчивыми материалами: цинком, хромом, никелем и другими металлами. Предохранительные свойства этих металлов, как и алюминия, основаны на том, что они покрываются тонкой устойчивой пленкой своих окислов, предохраняющих покрытие от дальнейшего разрушения.
Предохранительные покрытия значительно замедляют процесс окисления металла.
В природе постоянно происходят процессы медленного окисления, сходные с горением.
При гниении дерева, соломы, листьев и других органических веществ происходят процессы окисления углерода, входящего в состав этих веществ. Тепло при этом выделяется чрезвычайно медленно, и поэтому обычно оно остается незамеченным.
Но иногда такого рода окислительные процессы сами по себе ускоряются и переходят в горение.
Самовозгорание можно наблюдать в стоге мокрого сена.
Быстрое окисление с выделением большого количества тепла и света можно наблюдать не только при горении дерева, керосина, свечи, масла и других горючих материалов, содержащих углерод, но и при горении железа.
Налейте в банку немного воды и наполните ее кислородом. Затем внесите в банку железную спираль, на конце которой укреплена тлеющая лучинка. Лучинка, а за ней и спираль загорятся ярким пламенем, разбрасывая во все стороны звездообразные искры.
Это идет процесс быстрого окисления железа кислородом. Он начался при высокой температуре, которую дала горящая лучинка, и продолжается до полного сгорания спирали за счет тепла, выделяющегося при горении железа.
Тепла этого так много, что образующиеся при горении частицы окисленного железа накаляются добела, ярко освещая банку.
Состав окалины, образовавшейся при горении железа, несколько иной, чем состав окисла, образовавшегося в виде ржавчины при медленном окислении железа на воздухе в присутствии влаги.
В первом случае окисление идет до закиси-окиси железа (Fe3O4), входящей в состав магнитного железняка; во втором — образуется окисел, близко напоминающий бурый железняк, который имеет формулу 2Fe2O3 ∙ Н2O.
Таким образом, в зависимости от условий, в которых протекает окисление, образуются различные окислы, отличающиеся друг от друга содержанием кислорода.
Так, например, углерод в соединении с кислородом дает два окисла — окись и двуокись углерода. При недостатке кислорода происходит неполное сгорание углерода с образованием окиси углерода (СО), которую в общежитии называют угарным газом. При полном сгорании образуется двуокись углерода, или углекислый газ (СO2).
Фосфор, сгорая в условиях недостатка кислорода, образует фосфористый ангидрид (Р2O3), а при избытке — фосфорный ангидрид (Р2O5). Сера в различных условиях горения также может дать сернистый (SO2) или серный (SO3) ангидрид.
В чистом кислороде горение и другие реакции окисления идут быстрее и доходят до конца.
Почему же в кислороде горение идет энергичнее, чем в воздухе?
Обладает ли чистый кислород какими-то особыми свойствами, которых нет у кислорода воздуха? Конечно, нет. И в том и в другом случае мы имеем один и тот же кислород, с одинаковыми свойствами.
Только в воздухе кислорода содержится в 5 раз меньше, чем в таком же объеме чистого кислорода, и, кроме того, в воздухе кислород перемешан с большими количествами азота, который не только сам не горит, но и не поддерживает горение.
Поэтому, если непосредственно около пламени кислород воздуха уже израсходован, то другой его порции необходимо пробиваться через азот и продукты горения. Следовательно, более энергичное горение в атмосфере кислорода можно объяснить более быстрой подачей его к месту горения.
При этом процесс соединения кислорода с горящим веществом идет энергичнее и тепла выделяется больше. Чем больше в единицу времени подается к горящему веществу кислорода, тем пламя ярче, тем температура выше и тем сильнее идет горение.
А горит ли сам кислород?
Возьмите цилиндр и опрокиньте его вверх дном. Подведите под цилиндр трубку с водородом. Так как водород легче воздуха, он полностью заполнит цилиндр.
Зажгите водород около открытой части цилиндра и введите в него сквозь пламя стеклянную трубку, через которую вытекает газообразный кислород. Около конца трубки вспыхнет огонь, который будет спокойно гореть внутри цилиндра, наполненного водородом. Это горит не кислород, а водород в присутствии небольшого количества кислорода, выходящего из трубки.
Что же образуется в результате горения водорода? Какой при этом получается окисел?
Водород окисляется до воды. Действительно, на стенках цилиндра постепенно начинают осаждаться капельки конденсированных паров воды. На окисление 2 молекул водорода идет 1 молекула кислорода, и образуются 2 молекулы воды (2Н2 + O2 → 2Н2O).
Если кислород вытекает из трубки медленно, он весь сгорает в атмосфере водорода, и опыт проходит спокойно.
Стоит только увеличить подачу кислорода настолько, что он не успеет сгореть полностью, часть его уйдет за пределы пламени, где образуются очаги смеси водорода с кислородом, появятся отдельные мелкие вспышки, похожие на взрывы.
Смесь кислорода с водородом — это гремучий газ. Если поджечь гремучий газ, произойдет сильный взрыв: при соединении кислорода с водородом получается вода и развивается высокая температура.
Пары воды и окружающие газы сильно расширяются, создается большое давление, при котором может легко разорваться не только стеклянный цилиндр, но и более прочный сосуд.
Поэтому работа с гремучей смесью требует особой осторожности.
Кислород обладает еще одним интересным свойством. Он вступает в соединение с некоторыми элементами, образуя перекисные соединения.
Приведем характерный пример. Водород, как известно, одновалентен, кислород двухвалентен: 2 атома водорода могут соединиться с 1 атомом кислорода. При этом получается вода. Строение молекулы воды обычно изображают Н — О — Н. Если к молекуле воды присоединить еще 1 атом кислорода, то образуется перекись водорода, формула которой Н2O2.
Куда же входит второй атом кислорода в этом соединении и какими связями он удерживается? Второй атом кислорода как бы разрывает связь первого с одним из атомов водорода и становится между ними, образуя при этом соединение Н—О—О—Н. Такое же строение имеет перекись натрия (Na—О—О—Na), перекись бария.
Характерным для перекисных соединений является наличие 2 атомов кислорода, связанных между собой одной валентностью. Поэтому 2 атома водорода, 2 атома натрия или 1 атом бария могут присоединить к себе не 1 атом кислорода с двумя валентностями (—О—), а 2 атома, у которых в результате связи между собой также остается только две свободные валентности (—О—О—).
Перекись водорода можно получить действием разбавленной серной кислоты на перекись натрия (Na2O2) или перекись бария (ВаO2). Удобнее пользоваться перекисью бария, так как при действии на нее серной кислотой образуется нерастворимый осадок сернокислого бария, от которого перекись водорода легко отделить путем фильтрования (ВаO2 + H2SO4 → BaSO4 + Н2O2).
Перекись водорода, как и озон, — соединение неустойчивое и разлагается на воду и атом кислорода который в момент выделения обладает большой окислительной способностью. При низких температурах и в темноте разложение перекиси водорода идет медленно.
А при нагревании и на свету оно происходит значительно быстрее. Песок, порошок двуокиси марганца, серебра или платины также ускоряют разложение перекиси водорода, а сами при этом остаются без изменения.
Вещества, которые только влияют на скорость химической реакции, а сами остаются неизмененными, называются катализаторами.
Если налить немного перекиси водорода в склянку, на дне которой находится катализатор — порошок двуокиси марганца, разложение перекиси водорода пойдет с такой быстротой, что можно будет заметить выделение пузырьков кислорода.
Способностью окислять различные соединения обладает не только газообразный кислород, но и некоторые соединения, в состав которых он входит.
Хорошим окислителем является перекись водорода. Она обесцвечивает различные красители и поэтому применяется в технике для отбеливания шелка, меха и других изделий.
Способность перекиси водорода убивать различные микробы позволяет применять ее как дезинфицирующее средство. Перекись водорода употребляется для промывания ран, полоскания горла и в зубоврачебной практике.
Сильными окислительными свойствами обладает азотная кислота (HNO3). Если в азотную кислоту добавить каплю скипидара, образуется яркая вспышка: углерод и водород, входящие в состав скипидара, бурно окислятся с выделением большого количества тепла.
Бумага и ткани, смоченные азотной кислотой, быстро разрушаются. Органические вещества, из которых сделаны эти материалы, окисляются азотной кислотой и теряют свои свойства. Если смоченную азотной кислотой бумагу или ткань нагреть, процесс окисления ускорится настолько, что может произойти вспышка.
Азотная кислота окисляет не только органические соединения, но и некоторые металлы. Медь при действии на нее концентрированной азотной кислотой окисляется сначала до окиси меди, выделяя из азотной кислоты двуокись азота, а затем окись меди переходит в азотнокислую соль меди.
Не только азотная кислота, но и некоторые ее соли обладают сильными окислительными свойствами.
Азотнокислые соли калия, натрия, кальция и аммония, которые в технике получили название селитры, при нагревании разлагаются, выделяя кислород. При высокой температуре в расплавленной селитре тлеющий уголек сгорает так энергично, что появляется яркобелый свет.
Если же в пробирку с расплавленной селитрой вместе с тлеющим угольком бросить кусочек серы, горение пойдет с такой интенсивностью и температура повысится настолько, что стекло начнет плавиться.
Эти свойства селитры давно были известны человеку; он воспользовался этими свойствами для приготовления пороха.
Черный, или дымный, порох приготовляется из селитры, угля и серы. В этой смеси уголь и сера являются горючими материалами. Сгорая, они переходят в газообразный углекислый газ (СO2) и твердый сернистый калий (K2S). Селитра, разлагаясь, выделяет большое количество кислорода и газообразный азот. Выделившийся кислород усиливает горение угля и серы.
В результате горения развивается такая высокая температура, что образовавшиеся газы могли бы расшириться до объема, который в 2000 раз больше объема взятого пороха.
Но стенки замкнутого сосуда, где обычно производят сжигание пороха, не позволяют газам легко и свободно расширяться. Создается огромное давление, которое разрывает сосуд в его наиболее слабом месте.
Раздается оглушительный взрыв, газы с шумом вырываются наружу, унося с собой в виде дыма размельченные частицы твердого вещества.
Так из калийной селитры, угля и серы образуется смесь, обладающая огромной разрушительной силой.
К соединениям с сильными окислительными свойствами относятся и соли кислородосодержащих кислот хлора. Бертолетова соль при нагревании распадается на хлористый калий и атомарный кислород.
Еще легче, чем бертолетова соль, отдает свой кислород хлорная, или белильная, известь. Белильной известью отбеливают хлопок, лен, бумагу и другие материалы. Хлорная известь употребляется и как средство против отравляющих веществ: отравляющие вещества, как и многие другие сложные соединения, разрушаются под действием сильных окислителей.
Окислительные свойства кислорода, его способность легко вступать в соединение с различными элементами и энергично поддерживать горение, развивая при этом высокую температуру, уже давно обратили на себя внимание ученых различных областей науки. Особенно этим заинтересовались химики и металлурги. Но использование кислорода было ограничено, так как не было простого и дешевого способа получения его из воздуха и воды.
На помощь химикам и металлургам пришли физики. Они нашли очень удобный способ выделения кислорода из воздуха, а физико-химики научились получать его в огромных количествах из воды.
Источник: https://www.activestudy.info/ximicheskie-svojstva-kisloroda/