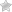Постоянный ток существует только в замкнутой цепи и сохраняет свое направление и основные параметры неизменными во времени. Для его поддержания необходимо наличие постоянного напряжения. Это требование является неизменным для различных источников постоянного тока.
Источники постоянного электрического тока
Существует несколько основных видов источников энергии постоянного тока. Каждый из них основан на использовании разных физических принципов и используется в определенных условиях. К ним можно отнести следующие виды:
- механические, превращающие механическую энергию вращения ротора в электрическую энергию;
- тепловые, в которых в электрическую энергию преобразуется тепловая энергия;
- химические, в которых в электрическую энергию преобразуется энергия, выделяющаяся в результате химического процесса;
- световые, превращающие энергию солнечного света в электрическую энергию.
В основном электроэнергия вырабатывается электростанциями, от которых потребители получают не постоянный, а переменный ток, который затем преобразуется в постоянный. Но во многих сферах можно применять только тепловые, световые или химические источники постоянного электрического тока.
Тепловые источники
В этих источниках используется термоэлектрический эффект. Электрический ток в замкнутой цепи возникает благодаря разнице температур, контактирующих между собой, металлов или полупроводниковых структур.
В месте контакта при нагреве возникает электродвижущая сила (термо-ЭДС). Электрический ток заряженных частиц направлен от нагретого участка в сторону холодного. Его величина пропорциональна разнице температур.
В месте спая образуется термопара.
Приборы, которые для создания постоянного тока используют тепло, выделяющееся при распаде радиоактивных изотопных материалов, являются радиоизотопными термоэлектрическими генераторами.
Световые источники
Свойство полупроводников создавать ЭДС при попадании на них потока света используется при создании световых источников постоянного тока.

Объединение большого количества кремниевых структур позволяет создавать солнечные батареи. Небольшие электростанции, созданные на базе таких солнечных панелей, имеют на сегодняшний день КПД не более 15%.
Химические источники
Получение положительных и отрицательно заряженных частиц в химических источниках постоянного тока осуществляется за счет химических реакций. По классификации химических источников они делятся на 3 группы:
*ХИТ — химические источники тока.
Гальванические элементы используют принцип действия, основанный на взаимодействии двух металлов через среду электролита. Вид и характеристики ХИТ зависят от выбранной пары металлов и состава электролита. Два металлических электрода источника тока по аналогии с прибором односторонней проводимости получили название анода («+») и катода («-«).
Материалом для изготовления анода могут служить свинец, цинк, кадмий и другие. Катод изготавливают из оксида свинца, графита, оксида марганца, гидрооксида никеля. По составу электролита гальванические элементы разделяются на 3 вида:
- солевые или «сухие»;
- щелочные;
- литиевые.
В элементах первых двух видов графито-марганцевый стержень (катод) помещен по оси цинкового цилиндрического стаканчика (анода). Свободное пространство между ними заполнено пастой на основе хлорида аммония (солевые) или гидрооксида калия (щелочные).

В литиевых элементах цинковый анод заменен щелочным литием, что привело к значительному увеличению продолжительности работы. Материал катода в них определяет выходное напряжение батарейки (1,5-3,7) В. Первичные ХИТ являются источниками одноразового действия. Его реагенты, расходующиеся в процессе работы, не подлежат восстановлению.
Аккумуляторы представляют собой устройства, в которых производится преобразование электрической энергии внешнего источника тока в химическую энергию при заряде и ее накопление. В процессе работы (разряд) происходит обратное преобразование — химическая энергия служит источником постоянного электрического тока.
К основным видам аккумуляторов относятся:
- свинцово-кислотные;
- никель-кадмиевые щелочные;
- литий-ионные.
Для создания химических процессов набор пластин помещен в раствор электролита. В АКБ, созданных по современным технологиям, раствор представляет собой не жидкость, а гелиевый состав (GEL) или сотовые сепараторы, пропитанные электролитом и помещенные между свинцовыми пластинами (AGM).

Свинцово-кислотные и никель-кадмиевые щелочные аккумуляторы для работы в качестве источников постоянного тока для запуска двигателей автомобилей собирают из набора отдельных аккумуляторных элементов («банок»).
Каждая «банка» обеспечивает на своих клеммах напряжение 2,1 В.
Соединенные последовательно 6 элементов и помещенные в ударопрочный корпус, имеют на выходных клеммах аккумулятора необходимые для запуска двигателя 12 В.
В литий-ионных аккумуляторах носителями электрического тока служат ионы лития. Они образуются на катоде, изготовленному из соли лития. Анод может быть изготовлен из графита или оксидов кобальта.
Напряжение постоянного тока на выходе аккумулятора может варьироваться в пределах (3,0-4,2) В в зависимости от используемых материалов. Эти аккумуляторы имеют низкое значение тока саморазряда и допускают большое количество циклов заряд/разряд.
Благодаря этому все современные гаджеты используют аккумуляторы этого вида.
Механические источники постоянного тока
Устройствами, преобразующими механическую энергию в электрическую, являются турбо и гидро генераторы. Они вырабатывают переменный электрический ток. Для основной части бытовых приборов источником постоянного тока выступают их блоки питания.
В них производится преобразование переменного напряжения генератора в постоянное напряжение, необходимое для работы устройств.
Эту задачу выполняют выпрямители, которые должны обеспечивать необходимую мощность источника постоянного тока для их нагрузки и постоянное значение выходного напряжения, не зависящее от потребляемого тока.
Блоки питания могут быть линейными и импульсными. Линейные блоки выполняются по разным схемам, основу которых составляют:
- однополупериодые выпрямители;
- двухполупериодные выпрямители.
В выпрямителях используется свойство полупроводниковых диодов пропускать ток только в одном направлении. Выпрямленное таким образом напряжение еще не является постоянным.
Емкости последующих за выпрямителем конденсаторов сглаживающего фильтра при своем быстром заряде и медленном разряде поддерживают величину положительного однополярного напряжения на определенном значении.
Его величина определяется трансформатором, получающим напряжение от генератора переменного тока. Для однофазного напряжения домашней сети 220 В 50 Гц его стальной сердечник имеет значительные размеры и вес.
Схемы однополупериодных содержат всего один полупроводниковый диод, пропускающий только одну полуволну синусоидального переменного входного напряжения.
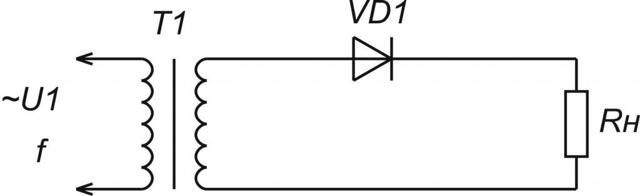
Двухполупериодные выпрямители выполняются по мостовой схеме или по схеме с общей точкой. В последнем случае вторичная обмотка сетевого трансформатора имеет вывод от своей середины. Эти выпрямители представляют собой параллельное включение двух однополупериодных выпрямителей. Они действуют на обе полуволны синусоиды переменного входного напряжения.
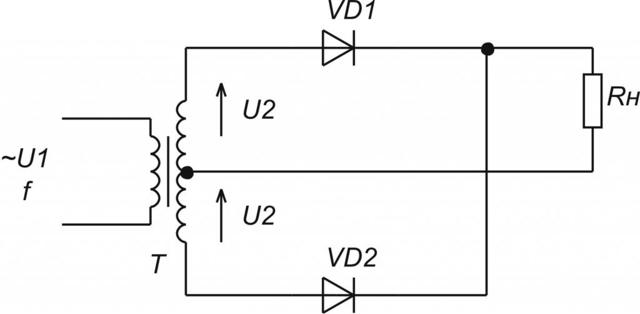
Мостовая схема выпрямителя является наиболее распространенной. Соединение 4-х диодов в ней напоминает «квадрат». К одной из диагоналей подключается переменное напряжение вторичной обмотки сетевого трансформатора. Нагрузка включается в другую диагональ «квадрата». Им будет входной элемент сглаживающего фильтра.
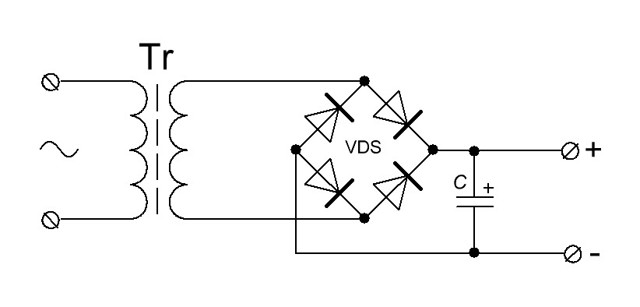
Регулирование источника
Для обеспечения постоянного значения уровня выходного напряжения, не зависящего от потребляемого нагрузкой тока и колебаний входного переменного напряжения, все современные источники питания постоянного тока имеют ступень стабилизации и регулирования.
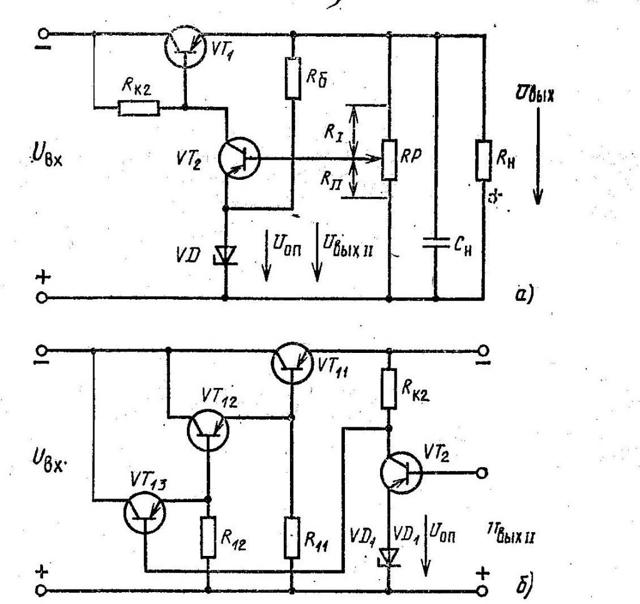
В ней выходное напряжение сравнивается с эталонным (опорным) значением.
При появлении различия между ними вырабатывается управляющий сигнал, который по цепи управления изменяет величину выходного напряжения. Величину значения опорного напряжения можно изменять в широких пределах, имея на выходе регулированного источника питания постоянного тока необходимое для работы напряжение.
Импульсные источники
Схемы с использованием входных трансформаторов напряжения сети получили название линейных.
В импульсных источниках питания производится двойное преобразование — сначала переменное напряжение выпрямителем преобразуется в постоянное, затем вырабатывается переменное импульсное напряжение более высокой частоты, которое в выходном каскаде снова преобразуется в постоянное напряжение необходимого значения.
Генераторы импульсов вырабатывают непрерывную импульсную последовательность с частотой (15-60) кГц.
Регулирование выходного напряжения осуществляется посредством широтно-импульсной модуляции (ШИМ), при которой уровень сигнала на выходе блока питания определяется шириной импульсов, вырабатываемых генератором и значением их скважности.
Регулированные источники питания постоянного тока импульсного типа все чаще используются при создании аппаратуры различного назначения.
Сравнение источников
Отсутствие мощного входного трансформатора в импульсных источниках питания позволяет создавать конструкции значительно более легкие и с меньшими линейными размерами. Их эффективность значительно выше источников, выполненных по линейным схемам. Коэффициент полезного действия доходит до значения 98%. В них широкое распространение получили микросхемы, выполняющие функции контроллеров.
Каждый из типов стабилизированных источников постоянного тока находит применение в своей сфере. А она весьма многообразна. Основой являются характеристики источников постоянного тока.
Линейные источники обеспечивают низкий уровень пульсаций выходного напряжения и малое значение уровня собственного шума. Это достигается отсутствием переключений при их работе, которые создают большой уровень помех в широком частотном диапазоне.
В импульсных источниках приходится применять сложные схемные решения для борьбы с ними, что приводит к удорожанию изделий, в которых они применяются.
Заключение
В статье был дан общий обзор существующих источников постоянного тока. Изложенный материал лишь знакомит читателей с основными принципами их работы. Из него можно сделать вывод, что каждый из видов источников постоянного тока используется в своей области.
Источник: https://www.syl.ru/article/472446/istochniki-postoyannogo-toka-vidyi-harakteristiki-sferyi-primeneniya
Какие существуют виды источников электрического тока?
Источник электрического тока – это устройство, с помощью которого создаётся электрический ток в замкнутой электрической цепи. В настоящее время изобретено большое количество видов таких источников. Каждый вид используется для определённых целей.
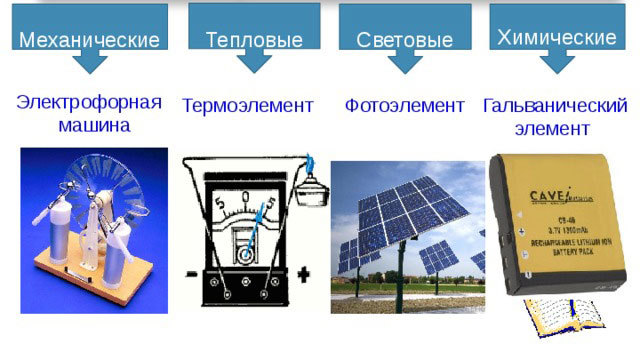
Виды источников электрического тока
Существуют следующие виды источников электрического тока:
- механические;
- тепловые;
- световые;
- химические.
Механические источники
В этих источниках происходит преобразование механической энергии в электрическую. Преобразование осуществляется в специальных устройствах – генераторах.
Основными генераторами являются турбогенераторы, где электрическая машина приводится в действие газовым или паровым потоком, и гидрогенераторы, преобразующие энергию падающей воды в электричество.
Большая часть электроэнергии на Земле производится именно механическими преобразователями.

Тепловые источники
Здесь преобразуется в электричество тепловая энергия. Возникновение электрического тока обусловлено разностью температур двух пар контактирующих металлов или полупроводников — термопар. В этом случае заряженные частицы переносятся от нагретого участка к холодному.
Величина тока зависит напрямую от разности температур: чем больше эта разность, тем больше электрический ток. Термопары на основе полупроводников дают термоэдс в 1000 раз больше, чем биметаллические, поэтому из них можно изготавливать источники тока.
Металлические термопары используют лишь для измерения температуры.
СПРАВКА! Чтобы получить термопару, необходимо соединить 2 различных металла.
В настоящее время разработаны новые элементы на основе преобразования тепла, выделяющегося при естественном распаде радиоактивных изотопов. Такие элементы получили название радиоизотопный термоэлектрический генератор.
В космических аппаратах хорошо себя зарекомендовал генератор, где применяется изотоп плутоний-238. Он даёт мощность 470 Вт при напряжении 30 В. Так как период полураспада этого изотопа 87,7 года, то срок службы генератора очень большой.
Преобразователем тепла в электричество служит биметаллическая термопара.
Световые источники
С развитием физики полупроводников в конце ХХ века появились новые источники тока – солнечные батареи, в которых энергия света преобразуется в электрическую энергию. В них используется свойство полупроводников выдавать напряжение при воздействии на них светового потока.
Особенно сильно этот эффект наблюдается у кремниевых полупроводников. Но всё-таки КПД таких элементов не превышает 15%. Солнечные батареи стали незаменимы в космической отрасли, начали применяться и в быту.
Цена таких источников питания постоянно снижается, но остаётся достаточно высокой: около 100 рублей за 1 ватт мощности.

Химические источники
Все химические источники можно разбить на 3 группы:
- Гальванические
- Аккумуляторы
- Тепловые
Гальванические элементы работают на основе взаимодействия двух разных металлов, помещённых в электролит. В качестве пар металлов и электролита могут быть разные химические элементы и их соединения. От этого зависит вид и характеристики элемента.
ВАЖНО! Гальванические элементы используются только разово, т.е. после разряда их невозможно восстановить.
Существует 3 вида гальванических источников (или батареек):
- Солевые;
- Щелочные;
- Литиевые.
Солевые, или иначе “сухие”, батарейки используют пастообразный электролит из соли какого-либо металла, помещённый в цинковый стаканчик. Катодом служит графито-марганцевый стержень, расположенный в центре стаканчика. Дешёвые материалы и лёгкость изготовления таких батареек сделали их самыми дешёвыми из всех. Но по характеристикам они значительно уступают щелочным и литиевым.

В щелочных батарейках в качестве электролита используется пастообразный раствор щёлочи — гидрооксида калия. Цинковый анод заменён на порошкообразный цинк, что позволило увеличить отдаваемый элементом ток и время работы. Эти элементы служат в 1,5 раза дольше солевых.
В литиевом элементе анод сделан из лития — щелочного металла, что значительно увеличило продолжительность работы. Но одновременно увеличилась цена из-за относительной дороговизны лития. Кроме того, литиевая батарейка может иметь различное напряжение в зависимости от материала катода. Выпускают батарейки с напряжением от 1,5 В до 3,7 В.
Аккумуляторы — источники электрического тока, которые можно подвергать многим циклам заряда-разряда. Основными видами аккумуляторов являются:
- Свинцово-кислотные;
- Литий-ионные;
- Никель-кадмиевые.
Свинцово-кислотные аккумуляторы состоят из свинцовых пластин, погружённых в раствор серной кислоты. При замыкании внешней электрической цепи происходит химическая реакция, в результате которой свинец преобразуется в сульфат свинца на катоде и аноде, а также образуется вода. В процессе зарядки сульфат свинца на аноде восстанавливается до свинца, а на катоде до диоксида свинца.
 СПРАВКА! Один элемент свинцово-цинкового аккумулятора вырабатывает напряжение 2 В. Соединив элементы последовательно, можно получить любое напряжение, кратное 2. Например, в автомобильных аккумуляторах напряжение 12 В, т.к. соединены 6 элементов.
СПРАВКА! Один элемент свинцово-цинкового аккумулятора вырабатывает напряжение 2 В. Соединив элементы последовательно, можно получить любое напряжение, кратное 2. Например, в автомобильных аккумуляторах напряжение 12 В, т.к. соединены 6 элементов.
Литий-ионный аккумулятор получил своё название из-за того, что в качестве носителя электричества в электролите служат ионы лития. Ионы возникают на катоде, который изготовлен из соли лития на подложке из алюминиевой фольги. Анод изготавливается из различных материалов: графита, оксидов кобальта и других соединений на подложке из медной фольги.
Напряжение в зависимости от применяемых компонентов может быть от 3 В до 4,2 В. Благодаря низкому саморазряду и большому количеству циклов заряда-разряда литий-ионные аккумуляторы приобрели большую популярность в бытовой технике.
ВАЖНО! Литий-ионные аккумуляторы очень чувствительны к перезарядке. Поэтому для их зарядки нужно использовать зарядные устройства, предназначенные только для них, которые имеют встроенные специальные схемы, предотвращающие перезаряд. Иначе может произойти разрушение аккумулятора и его возгорание.

В никель-кадмиевых аккумуляторах катод сделан из соли никеля на стальной сетке, анод из соли кадмия на стальной сетке, а электролит — смесь гидроксида лития и гидроксида калия. Номинальное напряжение такого аккумулятора — 1,37 В. Он выдерживает от 100 до 900 циклов зарядки-разрядки.
СПРАВКА! Никель-кадмиевые аккумуляторы можно хранить в разряженном состоянии, в отличии от литий-ионных.
Тепловые химические элементы служат как источники резервного питания. Они дают отличные характеристики по удельной плотности тока, но имеют короткий срок службы (до 1 часа). Применяются в основном в ракетной технике, где нужны надёжность и кратковременная работа.
ВАЖНО! Первоначально тепловые химические источники не могут давать электрический ток. В них электролит содержится в твёрдом состоянии и для приведения батареи в рабочее состояние необходим разогрев до 500-600°C. Такой разогрев осуществляется специальной пиротехнической смесью, которая воспламеняется в нужный момент.
Отличие реального источника от идеального
Идеальный источник по законам физики должен обладать бесконечным внутренним сопротивлением, чтобы обеспечить постоянство электрического тока в нагрузке. Реальные источники имеют конечное внутренне сопротивление, а значит ток зависит как от внешней нагрузки, так и от внутреннего сопротивления.
Вот вкратце и всё о разнообразии современных источников электрического тока. Как видно из обзора, на сегодняшний день создано внушительное количество источников с характеристиками, подходящими для любой сферы применения.
Источник: https://odinelectric.ru/elektrosnabzhenie/vidy-istochnikov-electricheskogo-toka
Химические источники тока
Радиоэлектроника для начинающих
К химическим источникам тока причисляют гальванические элементы и аккумуляторы. Есть и другие химические источники тока, но они менее распространены. В обиходе гальванический элемент получил название батарейка. Это не совсем верное определение, так как батарейкой можно назвать несколько отдельных гальванических элементов соединённых вместе – это и есть батарея питания или батарейка.
Узнайте подробнее о правильном соединении элементов питания.
На принципиальных схемах гальванический элемент обозначается так.

Так обозначают один гальванический элемент или один элемент аккумулятора.
Но поскольку номинальное напряжение на одном гальваническом элементе обычно не более 1,5 вольта, их соединяют в батареи питания. Батарея питания на принципиальной схеме обозначается вот так.
Здесь показано, что батарея питания состоит из двух отдельных гальванических элементов. Общее напряжение на полюсах этой составной батареи — 3 вольта из расчёта, что каждый из элементов имеет на полюсах напряжение 1,5 вольта. Также на схемах можно встретить и такое обозначение.

Это тоже условное изображение батареи питания или батарейки на принципиальной схеме, только здесь не уточняется, сколько именно гальванических элементов используется в батарее, а указано лишь общее напряжение на полюсах батареи.
Одиночный аккумуляторный элемент обозначается на схемах так же, как и отдельный гальванический элемент. Номинальное напряжение одного аккумуляторного элемента обычно составляет около 1,25 вольт.
Чтобы получить аккумулятор с большим напряжением аккумуляторные элементы соединяют вместе – получается аккумуляторная батарея или просто аккумулятор.
Обозначение аккумуляторной батареи на схемах такое же, как и батареи, составленной из гальванических элементов.
Чем гальванический элемент отличается от аккумулятора?
Дело в том, что гальванический элемент сам является источником постоянного тока, который образуется за счёт необратимой химической реакции. Гальванический элемент причисляют к первичным источникам тока.
Аккумулятор является так называемым вторичным источником тока. Почему? Потому, что перед тем, как использовать аккумулятор, его нужно предварительно зарядить от источника постоянного тока — зарядника.
Только после полной зарядки аккумулятор сможет питать электронное устройство. Отличительным качеством аккумуляторов является то, что их можно заряжать и разряжать много раз.
В отличие от аккумулятора, гальваническая батарея питания после своего полного разряда не может быть использована повторно.
Какие существуют батарейки?
Наибольшее распространение в настоящее время получили щелочные батареи питания. Их ещё называют алкалиновыми – производное от английского слова alkaline – «щелочь».
Работа щелочной батарейки основана на окислительно-восстановительной химической реакции между цинком и диоксидом марганца.
Результатом, а точнее полезным продуктом этой реакции является электрический постоянный ток и тепло, которое не используется. Электрическая ёмкость щелочной батарейки составлет около 1700 — 3000 мАч.
По величине своей ёмкости, щелочные батарейки лидируют по сравнению с солевыми батарейками, электроёмкость которых меньше и составляет 550 — 1100 мАч.
Щелочная батарейка устроена следующим образом. Взглянем на рисунок.
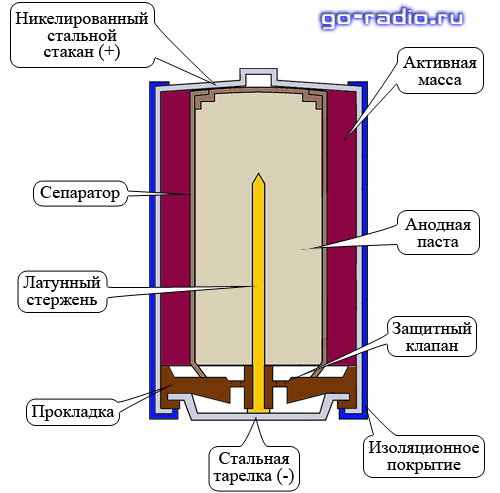
Корпусом элемента является никелированный стальной стакан. Он же является плюсовым контактом батарейки «+». Активная масса представляет собой смесь диоксида марганца (MnO2) и графита.
Анодная паста – это смесь порошка цинка (Zn) и густого щелочного электролита. Электролитом обычно служит раствор гидроксида калия (KOH). Анодная паста отделена от активной массы сепаратором.
Сепаратор разделяет реагенты, исключая их перемешивание и нейтрализацию заряда. Также сепаратор пропитан электролитом.
Отрицательный потенциал снимается с латунного стержня, который окружён анодной пастой. Стальная тарелка контактирует с латунным стержнем – токосъёмником и является отрицательным контактом элемента «—».
Прокладка изолирует никелированный стальной стакан от стальной тарелки, препятствуя тем самым короткому замыканию. Кроме этого прокладка сдерживает давление газа, который в незначительном количестве образуется при химической реакции.
В толще прокладки имеется защитный клапан или по-другому предохранительная мембрана. Защитный клапан служат для того, чтобы при чрезмерном давлении газа сработать и выпустить его наружу. Это предотвращает взрыв щелочного элемента, но и приводит к его разгерметизации.
Как правило, разгерметизация приводит к течи электролита.
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Он может вызвать коррозию контактов.
Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Как работает щелочной элемент
Для начала, маленькое отступление…
Как вы заметили, почему то анодная паста соединяется с помощью токосъёмника с отрицательным контактом элемента – стальной тарелкой. А ведь анод – это «+». Получается нестыковочка…
В чём тут дело? А дело в том, что в электронике есть один каламбур. По умолчанию, за направление тока в электрической цепи считается направление от плюса (анода) к минусу (катоду) – так повелось ещё с тех времён, когда электроника ещё зарождалась.
Но ведь электрический ток, как известно, это упорядоченное движение электронов, которые имеют отрицательный заряд.
И поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов).
При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. Именно поэтому образуется эта нестыковка, которая порой вводит начинающих радиолюбителей в ступор.
В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления. Так вот в щелочной батарейке (и не только) на аноде в результате окисления образуется избыток электронов.
То есть по сути – это катод, «минус». Но, как уже говорилось, в электрохимии всё наоборот.
Итак, электроны вырабатываются анодной пастой – смесью цинкового порошка (Zn) и густого электролита (раствора KOH).
Катодом же считается электрод, где происходит реакция восстановления.
Далее электроны, которые были получены в результате реакции окисления, проходят по электрической цепи электронного прибора, и возвращаются опять в батарейку, но уже на катод, где эти электроны используются для восстановительной химической реакции.
Катод – это диоксид марганца. Токоприёмником катода служит никелированный стальной стакан, который контактирует с активной массой – диоксидом марганца (MnO2).
Вот такая игра в наоборот. Напомню ещё раз, что в электронике за направление тока в цепи считается направление от плюса-«анода» к минусу-«катоду». В электрохимии всё наоборот. С этим и связаны особенности в названии реагентов химического источника тока.
Можно ли заряжать батарейки?

А вот в аккумуляторах используется обратимая химическая реакция, которая позволяет заряжать и разряжать их множество раз. Поэтому аккумуляторы и называют вторичными источниками тока.
Несмотря на это, известно, что щелочные элементы допускают перезарядку, т.е. их можно зарядить и использовать повторно. Но такие, перезаряжаемые щелочные элементы имеют свою особую конструкцию.
Также стоит отметить, что даже такие элементы нельзя перезаряжать много раз, обычно не более 25. В широкой продаже такие щелочные элементы не встречаются.
Их маркируют как Rechargeable Alkaline Manganese.
Из всего этого следует, что заряжать обычные щелочные батарейки категорически не стоит. Такие эксперименты могут завершиться взрывом батарейки и разбрызгиванием электролита. А это не есть гуд +опасно для здоровья .
Чтобы замедлить химическую реакцию в щелочном элементе и, тем самым, продлить срок её хранения и снизить саморазряд батареи, в них раньше добавляли кадмий и ртуть. Эти вещества замедляли химическую реакцию, и цинк окислялся медленнее. Но, из-за токсичности ртути и кадмия их сейчас не используют, а применяют другие, менее вредные ингибиторы.
На многих батарейках можно даже увидеть надпись – 0% кадмия и ртути или 0% Hg & Cd. Это своеобразный маркетинговый ход, как бы намекающий на то, что данные батарейки безопасны.
Если вы с успехом дошли до этих строк, то теперь вас можно поздравить, ведь теперь вы знаете, как устроена и работает щелочная батарейка. И поэтому её и не обязательно разбирать . Кроме щелочных элементов питания существуют и другие, но об их устройстве мы расскажем в другой раз.
Главная » Радиоэлектроника для начинающих » Текущая страница
Также Вам будет интересно узнать:
-
Собираем блок питания своими руками.
-
Зачем нужен трансформатор?
Источник: https://go-radio.ru/ximicheskie-istochniki-toka.html
Химические источники тока — это… Что такое Химические источники тока?
Хими́ческие исто́чники то́ка (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
История создания
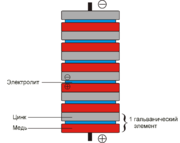
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж.
Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Принцип действия
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции.
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
- в качестве восстановителя (на аноде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (на катоде) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока
Гальванические элементы
Смотри также Категория:Гальванические элементы.
Другие типы:
Аккумуляторы
Смотри также Категория:Аккумуляторы.
Топливные элементы
Смотри также Категория:Топливные элементы.
Ссылки
- О химических источниках тока
Источник: https://biograf.academic.ru/dic.nsf/ruwiki/1583971/biograf.academic.ru/dic.nsf/ruwiki/84512
Лекция по теме «Химические источники тока»
Учебные
вопросы
-
Виды химических источников тока
-
Классификация гальванических элементов
-
Принцип действия аккумулятора
-
Топливные элементы
-
Виды химических источников тока
Химическими источниками тока
(ХИТ) называются электрохимические
устройства, в результате работы которых
химическая энергия окислительно-восстановительных
процессов превращается в электрическую
энергию постоянного тока. К ним относятся гальванические элементы, аккумуляторы,
топливные элементы.
Во всех видах
химических источниках тока используются
электролиты – водные, неводные, твердые.
К достоинствам современных ХИТ относятся
относительно высокие КПД (до 0,8) и высокая
удельная мощность (количество энергии,
отдаваемое в единицу времени единицей
массы ХИТ), что позволяет им конкурировать
с другими источниками тока.
Основным
их недостатком является ограниченный
срок службы.
-
Классификация гальванических элементов
Среди
большого разнообразия гальванических
элементов можно выделить три основных
типа.
Первый
тип
.
Пластины из двух различных металлов
находятся в растворах солей, содержащих
собственные ионы. К этому типу относится
медно-цинковый гальванический элемент
(элемент Даниэля – Якоби ).
Второй
тип. Пластины из двух различных металлов
находятся в растворе одного электролита.
Примером может служить элемент Вольта,
состоящий из двух пластин (Zn и Cu), погруженных в раствор серной кислоты.
При его работе происходят следующие
процессы:
- (-)
А: Zn Zn2+
+ 2- окисление (анодный процесс) - (+)
К: 2Н+
+ 2
Н2—
восстановление (катодный процесс) -
Выделяющийся
водород насыщает поверхность катода (меди), в результате чего получается
электрод другого состава (не медный, а
водородный). -
Схема
гальванического элемента Вольта:
(-)
Zn /
Zn2+
H2SO4
2H+
/
H2
(Cu) (+)
В
скобках справа указывается (Сu) — место
выделения водорода.
Третий
тип.
Гальванические элементы составлены из
двух совершенно одинаковых по природе электродов (например, медных), погруженных
в растворы одного и того же электролита,
но различной концентрации. Такие элементы
называются концентрационными.
Схема
медного концентрационного гальванического
элемента:
-
(-)
Cu /
CuSO4 CuSO4
/
Cu
(+) , - C1 < С2
- где C1 и С2
— концентрация раствора электролита,
моль/л.
Роль
анода выполняет электрод, находящийся
в более разбавленном растворе, так как его электродный потенциал имеет более низкое значение по сравнению со вторым
электродом. ЭДС такого гальванического
элемента зависит только от соотношения
концентраций потенциалопределяющих ионов (в данном случае от концентрации
CuSO4).
Практического
значения как источники электрической
энергии концентрационные гальванические
элементы не имеют.
-
Принцип действия аккумулятора
Аккумуляторы
– гальванические элементы,
которые на основе обратимых электрохимических
реакций могут многократно накапливать
химическую энергию и отдавать ее для
потребления в виде электрической энергии
постоянного тока.
Аккумуляторы
— устройства многоразового действия,
сочетающие в себе гальванический элемент
и электролизер.
Под воздействием
внешнего постоянного тока в них
аккумулируется (накапливается) химическая
энергия, которая затем превращается в
электрическую в результате
окислительно-восстановительной реакции.
Процесс накопления химической энергии
называют зарядом
аккумулятора,
процесс ее превращения в электрическую
— разрядом
аккумулятора.
В первом случае аккумулятор работает
как электролизер, во втором – как
гальванический элемент.
Устройство
и принцип действия всех аккумуляторов
одинаков. Основное отличие состоит в
материале электродов и типе электролита.
На аноде как при разряде, так и при заряде
протекает процесс окисления, на катоде
– процесс восстановления.
Наиболее
распространенными являются кислотные
и щелочные аккумуляторы.
Кислотный
аккумулятор (свинцовый
аккумулятор)
представляет собой пластины в виде
отливок из хартблея (твердого свинца с
примесью сурьмы) ячеистой структуры,
собранные в батареи и помещенные в баки
из эбонита или полипропилена с
электролитом.
В ячейки пластин
предварительно запрессовывается смесь
оксида свинца (PbO)
с глицерином, обладающая способностью
затвердевать в виде глицерата свинца.
Электролитом служит раствор серной
кислоты (35 — 40 % раствор H2SO4).
При взаимодействии оксида свинца с
H2SO4 образуется
PbSO4.
PbOтв.
+ H2SO4(р-р)
PbSO4тв.
+
H2O
- При первичной и последующих зарядах
аккумулятора, когда он работает как
электрохимическая ячейка, PbSO4
на катоде превращается в свинец (Pb),
а аноде — в диоксид свинца (PbO2),
которые и являются электродами: -
(-) К : PbSO4(тв) + 2Pb(тв)
+ SO(р-р) -
(+) А : PbSO4(тв) +2 Н2О
PbО2(тв)
+ 2+ 4 Н+
+ SO(р-р)
-
2PbSO4(тв)
+ 2H2O Pb(тв)
+ PbO2(тв)
+ 2 H2SO4(р-р) - ЭДС
заряженного аккумулятора приблизительно
равна 2 В (если 6 таких аккумуляторов
последовательно соединить, получается
обычный автомобильный аккумулятор с
ЭДС = 12В). -
При
работе аккумулятора – его разрядке,
когда он работает как химический источник
тока, на электродах протекают электродные
процессы в обратном направлении.
По
мере его разрядки расходуются материалы катода (PbО2)
, анода (Pb) и электролит — серная кислота.
Напряжение на зажимах аккумулятора
падает и его необходимо заряжать. Для
зарядки аккумулятор подключают к
внешнему источнику тока, направление
тока противоположно разрядному.
-
Токообразующие
и электродные реакции в свинцовом
аккумуляторе можно представить в виде: - Pb(тв)
+ SO(р-р) PbSO4(тв) + 2 -
PbО2(тв)
+ 2+
4 Н+(р-р)+
SO(р-р)
PbSO4(тв)
+ 2 Н2О -
«разрядка»
-
Pb(тв)
+ PbO2(тв)
+ 2 H2SO4
(р-р) 2 PbSO
4(тв)
+ 2H2O - «зарядка»
-
Cхема
кислотного аккумулятора: - (
— ) Pb
/ Pb2+
│H2SO4
│Pb2+
/ PbO2( + )
-
Стандартные
величины потенциалов для электродов
свинцового аккумулятора имеют следующие
значения: ,. - ЭДС
аккумулятора, как химического источника
тока, рассчитывается по уравнению: - — +
Из
данного уравнения видно, что ЭДС
аккумулятора зависит от концентрации
(активности) серной кислоты, которая
возрастает при заряде аккумулятора и
уменьшается при его разояде. О степени
разряда аккумулятора судят по концентрации
электролита, т.е. концентрации H2SO4.
Используя концентрированные растворы
H2SO4,
можно было бы увеличить ЭДС аккумулятора,
однако при концентрации H2SO4
больше 39% резко уменьшается электропроводность
растворов и увеличивается растворимость
свинца, поэтому оптимальными являются
32 — 39 % — ные растворы H2SO4.
- Во
время заряда аккумулятора растет
напряжение на его полюсах. В конце оно
достигает такого значения, что начинается
электролиз воды, сопровождающийся
выделением водорода на катоде и кислорода
– на аноде: -
(-)
К : 2 Н2О
+ 2
Н2+2
ОН- -
(+)
А : 4 ОН-
О2+ 2 Н2О
+ 4
2
Н2О
2 Н2+
О2
Так
называемое «кипение» электролита
является признаком окончания заряда
свинцового аккумулятора. Заряженный
аккумулятор может быть сразу использован
по назначению. При хранении же из него
выливают электролит и промывают водой.
В таком виде он может находиться до 2 лет и для его использования достаточно
лишь залить электролит.
При хранении
незаряженного аккумулятора с раствором
серной кислоты происходит его
«сульфатирование» – образование на
пластинках большого количества PSO4.
Когда кислотный аккумулятор работает,
давая ток, PSO4
осаждается в очень мелкозернистой форме
на поверхности электродов.
Когда же
аккумулятор выключен, мелкозернистый
слой рекристаллизуется и образуются
более крупные кристаллы, которые могут
закупорить поры электрода, уменьшая
его поверхность или отрываться от
электрода и оседать на дно аккумулятора.
Процесс сульфатации является основной
причиной выхода аккумулятора из строя,
поэтому нужно следить, чтобы аккумулятор
не простаивал частично в разряженном
состоянии.
Преимущества
свинцового аккумулятора – высокий КПД (около 80 %), высокая ЭДС и относительно
малое ее изменение при разряде, большая
электрическая емкость, устойчивость в
работе. Недостатки – большая масса и,
следовательно, малая удельная емкость,
саморазряд аккумулятора при хранении,
малый срок службы (2 – 5 лет), а также
токсичность свинца и сильные окислительные
свойства H2SO4.
Щелочные
аккумуляторыразличаются
по материалу пластин отрицательно
заряженного электрода. Наиболее
распространенные из них кадмий —
никелевые (Cd
— Ni) и железо — никелевые ( Fe
– Ni
) аккумуляторы.
Активная масса положительных
пластин состоит, в основном, из
гидратированного оксида никеля (III),
кроме того в ней содержится графит,
добавляемый для увеличения
электропроводности. Электролитом служит
раствор КОН (20 %), содержащий небольшое
количество LiOH.
ЭДС заряженного аккумулятора (Cd
— Ni)
приблизительно равна 1,3
В.
Источник: https://studfile.net/preview/3871822/
Химические источники тока
Химические источники тока (ХИТ) — это такие источники тока, в которых химическая энергия активных веществ при протекании пространственно разделенных окислительно-восстановительных процессов превращается непосредственно в электрическую.
Совокупность активных веществ, на основе которых работает химический источник тока, называется электрохимической системой. Она может быть обратимой, когда образовавшиеся в процессе разряда вещества могут быть превращены в первоначальные, и необратимой.
когда обратное превращение невозможно.
Химические источники тока делятся на первичные, вторичные и топливные элементы. Источники тока, действие которых основано на использовании энергии необратимых химических систем, называют первичными, одноразовыми элементами.
Такие гальванические элементы и их комбинации в обиходе называют батарейками, хотя в технической литературе этот термин относится к батарее из нескольких элементов (англ. cell — элемент, baterry cell — батарея элементов).
Вторичные многоразовые источники тока работают за счет обратимых химических реакций, которые могут происходить в цикле «зарядка — разрядка» до тысячи раз. Одиночные вторичные аккумуляторные элементы и их комбинации обычно называют аккумуляторами. Кроме того, используются аккумуляторные батареи.
Каждый элемент состоит из корпуса электродов и загущенного или твердого электролита. Химические процессы, обеспечивающие образование тока, протекают в электролите (загущенный раствор хлорида аммония) между анодом и катодом.
Системы, образующие анод — катод, могут быть марганцево-цинковыми, воздушно-цинковыми, ртутно-цинковыми (с твердым электролитом).
У марганцево-цинковых элементов анодом является цинковый сосуд, а катодом — угольный стержень с выводом наружу, вокруг которого уложен деполяризатор из смеси графита и диоксида марганца. В воздушно-цинковых элементах отрицательным электродом является цинк, положительным — кислород воздуха.
Ртутно-цинковые элементы, у которых анодом является оксид ртути, а катодом цинковый порошок, обладают большей емкостью и величиной разрядного тока, чем марганцево-цинковые и воздушно-цинковые элементы.
Ассортимент химических источников тока является вторичным по отношению к рынку аппаратов-потребителей, что привело к возникновению множества типов и видов химических источников тока.
Химический источник тока характеризуется электрохимической системой; начальным и конечным напряжениями; емкостью; количеством циклов «зарядка – разрядка; интервалом температур, в котором они сохраняют заданные показатели; формой (цилиндрические разных диаметров и длин, квадратные, прямоугольные, в виде галет, круглые плоские); размерами; номинальным током разряда, А; гарантийным сроком хранения; продолжительностью работы.В настоящее время широко используются 11 систем первичных и 12 систем вторичных ХИТ.
Классификация химических элементов предусматривает три группы. Первая группа — простые элементы Лекланше напряжением 1,5 В.
Отрицательными полюсами являются дно цинкового стаканчика, положительный латунный колпачок иа конце графитового стержня. Они имеют простой солевой электролит, малую емкость и не имеют специального защитного корпуса; стаканчик обернут кабельной бумагой.
В процессе работы элемент быстро разрушается, электролит через бумажную оболочку протекает внутрь аппарата.
Вторая группа — конструктивно усовершенствованные элементы Лекланше. Изделия характеризуются плотной набивкой активных элементов, что увеличивает их емкость иа 30%, и наличием более эффективного хлоридного электролита.
Показателем качества является внешний вид дна. Если дно отрицательного вывода элемента плоское, то его следует отнести к первой или второй группе.
Конструкция дна, выполненная в виде штампованной фасонной шайбы, позволяет отнести элемент к третьей группе.
Третья группа — это элементы с хлоридным электролитом и специальными добавками в активные материалы.
Их конструкция более герметична, а между цинковым стаканчиком и металлическим или пластмассовым корпусом есть особая прокладка Элементы третьей труппы бывают двух разновидностей: емкость у первых увеличена на 60-70%, у вторых — почти вдвое.
Их срок годности увеличен до 24 мес. Отсутствие единых требований к маркировке элементов на международном уровне не позволяет точно определить их принадлежность к группам.
Цилиндрические алкалические элементы, использующие щелочной электролит и металлический стакан, отличаются высокой степенью герметичности и емкостью, в три раза большей, чем у цементов с хлоридным электролитом. Ил срок службы составляет до 5 лет, а масса на 15-20% больше, чем у предыдущих цементов. В маркировку этих изделий дополнительно вносится буква L.
К вторичным источникам тока относят аккумуляторы.
В них в качестве электролита используют раствор серной кислоты (кислотные аккумуляторы с положительным электродом из диоксида свинца и отрицательным — из губчатого свинца) и раствор гидроксида калия (щелочные аккумуляторы систем гидроксида никель-железа, гидроксида никель-кадмия и др.). Их ассортимент подразделяется по числу элементов, емкости, напряжению и по форме.
Номинальная емкость аккумулятора (А*ч) — количество электричества, которое он может отдать при разряде до определенного снижения напряжения.
На количество циклов и емкость аккумулятора влияют характер подключения нагрузки (непрерывный, переменный или импульсный), отбираемая мощность (максимальная, средняя, минимальная), режим заряда (нормальный, ускоренный, быстрый/форсированный), постоянный режим подзаряда.
Зарядные и разрядные характеристики определяют время стандартного или быстрого заряда и допустимые при этом напряжение и токи. При стандартном времени заряда емкость аккумулятора больше, чем при быстром, что позволяет обеспечить большие разрядные токи и время работы.
При импульсной (повторно-кратковременной) нагрузке, когда время рабочего цикла меньше следующей за ним паузы, величина разрядного тока может быть в несколько раз больше, чем при обычном разряде. Учитывая эти обстоятельства, выпускаются отдельные группы аккумуляторов с одним профилирующим параметром. В конструкции аккумуляторов в виде элементов или батарей предусмотрено наличие встроенного или автономного зарядного устройства. .
В бытовой радиоэлектронной аппаратуре широко применяются никель-кадмиевые аккумуляторы. По сравнению с кислотными аккумуляторами щелочные аккумуляторы лучше переносят тряску, короткие замыкания и при равных электрических показателях в три раза легче.
Кислотные аккумуляторы отличаются большой емкостью, способностъю подзаряжаться от генератора во время использования, значительным током разряда.
В то же время они способны терять свои свойства при хранении и несвоевременной зарядке. Их применяют в автомобилях, например для питания термоэлектрических холодильников.
За последние годы конструкция кислотных аккумуляторов существенно изменилась.
Появились необслуживаемые или малообслуживаемые аккумуляторы. обеспечена иммобилизация («неподвижность») электролита, выпушены герметизированные модели, улучшена работа в буферных режимах со сроком службы до 25 лет и увеличением ресурса до 800 циклов. Сформирована единая стандартизация кислотных аккумуляторов.
К преимуществам литиевых аккумуляторов относятся высокое рабочее напряжение 3,6 В, малые габаритные размеры, наличие встроенных микропроцессорных устройств в зарядных системах.
Для удобства потребителей в конструкции химических источников тока (например, алкалические элементы Duracell, Energizer) предусмотрены электрохимические индикаторы, позволяющие оценить величину электрической энергии по интенсивности окраски полосы тестера, появлению надписей или др.
По оценке экспертов, на рынке химических источников тока представлены 24 отечественные и 71 зарубежная торговые марки.
На упаковке качественных ХИТ (прозрачная полимерная потребительская тара (блистер), наклеенная на картонную основу, содержащую 1-4 элементов) должны быть указаны страна — производитель товара; название торговой марки со знаком регистрации, например Duracell R; адрес фирмы и ее представительства в России; срок годности; сертификат соответствия; типоразмер по 2-4 стандартам (например ANSI, DIN, NEDA); краткие рекомендации по эксплуатации. Кроме блистеров для упаковки батареек используют прозрачную термоусадочную пленку, или пленку в виде мешочка (у батареек напряжением 9 В), и коробки для батареек на 24 шт., не имеющих или имеющих индивидуальную упаковку. Кроме обязательной информации, производитель указывает особые свойства источника тока, как правило, на английском языке (Extra Power, Heavy Duly, Super Heavy Duty, Nothing Last Longer, 0%, Mercury — без ртути).
Источник: https://hron.com.ua/kultura/himiya/himicheskie-istochniki-toka/