Почему неон светится?
 Неон
Неон
Неон — это газ. До конца 19 века он спокойно исполнял почетную обязанность быть частью земной атмосферы. Но тут его открыл английский химик Уильям Рамзай. И спокойной жизни пришел конец. Находчивые инженеры изобрели неоновые лампы, и в 20 годы 20 столетия неоновая реклама покорила весь мир.
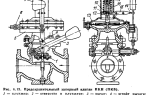
Настоящий цвет свечения неона
Когда мы думаем о неоне, то представляем себе горящие разными цветами названия магазинов и ресторанов. На самом – то деле неон светится ярким красно – оранжевым светом. Богатой гаммы цветов добиваются введением в газ ламп паров ртути и натрия. В Лас-Вегасе улицы ярко освещены изогнутыми газовыми трубками, зазывающими туристов поиграть в казино или послушать пение Уэйна Ньютона.
Как добывают неон?
Неон содержится в атмосфере, поэтому может именно в этот момент, вы вдыхаете чуть – чуть неона. Не волнуйтесь, в одном литре воздуха неона так мало, что его не хватит, чтобы наполнить зернышко воздушной кукурузы. Чтобы отделить неон от воздуха, воздух приходиться сжижать.
Точно так же как вода, когда она при охлаждении переходит из парообразного состояния в жидкое, воздух при снижении температуры превращается в жидкость. Только с водой это происходит при 100 градусах Цельсия, а с неоном при минус 246 градусах Цельсия – именно такова температура кипения неона.
Жидкий неон отделяется от других составных частей воздуха. При сжижении неон получается в смеси с азотом и гелием.
Повышая температуру и давление смеси, химики удаляют из нее азот. Гелий удаляется с помощью процесса, называемого адсорбцией. При этом молекулы газов осаждают на твердых веществах.
Молекулы неона лучше пристают к поверхности активированного угля, чем молекулы гелия. Это их свойство используют для разделения смеси.
Чтобы получить один килограмм неона, надо обработать 88000 килограммов воздуха.
Если налить холодный жидкий неон в стакан, можно увидеть, что он прозрачный и бесцветный — во всяком случае, на ярко – красную расцветку нет и намека.
Почему же тогда в рекламе неон ярко светится разными цветами? Закачанный в трубки неон состоит из миллиардов и миллиардов атомов. Каждый атом неона имеет на орбите вокруг ядра десять электронов.
Оба конца неоновой трубки подключены к электрической цепи.
Когда ток включен, он проходит вдоль трубки: электроны перескакивают с атома на атом, как им и положено при прохождении тока. Атомы неона возбуждаются при столкновении с электронами так же, как человек, которого грубо толкнули в толпе.
Электроны в атоме неона не склонны к бродяжничеству, поэтому после возбуждения атом успокаивается и электрон возвращается на свое место. В результате атом испускает фотон света.
Энергия этих фотонов лежит в красной части спектра видимого света.
Почему черная дыра черная
Цвета дру
Источник: https://kipmu.ru/neon-svetitsya/
Формула Неона структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: Ne
Молекулярная масса: 20,179
Нео́н (лат. Neon; обозначается символом Ne)- элемент восемнадцатой группы (по устаревшей классификации — главной подгруппы восьмой группы), второго периода периодической системы химических элементов, с атомным номером 10. Инертный газ.
Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Простое вещество неон — инертный одноатомный газ без цвета и запаха.
Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
История
Неон открыли в июне 1898 года английские химики Уильям Рамзай и Морис Траверс.
Они выделили этот инертный газ «методом исключения» после того, как кислород, азот и все более тяжёлые компоненты воздуха были сжижены.
Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
Происхождение названия
т от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространённость
Во Вселенной
В мировой материи неон распределен неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе.
Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна.
В атмосфере многих звезд неон занимает третье место после водорода и гелия.
Земная кора
Из всех стабильных элементов второго периода неон — самый малораспространённый на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10−3% по объёму, а его общие запасы оцениваются в 7,8·1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объёме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7·10−9% по массе. Всего на нашей планете около 6,6·1010 т неона.
В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Определение
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
- Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
- Насыщенность внешних электронных оболочек атомов инертных газов обусловливает более низкие точки сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения.
Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы
Существует три стабильных изотопа неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %). Повсеместно преобладает легкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе.
Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжелого кислорода 18О и фтора 19F:
188O + 42He → 2110Ne + 10n
199F + 42He → 2210Ne + 11H Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен. Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует ещё шестнадцать нестабильных.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха на крупных промышленных установках. Разделение «неоно-гелиевой» смеси осуществляется несколькими способами за счет адсорбции и конденсации и низкотемпературной ректификации.
Адсорбционный метод основан на способности неона, в отличие от гелия, адсорбироваться активированным углем, охлаждаемым жидким азотом.
Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом, ректификационный способ основан на разнице температур кипения гелия и азота.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.
55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2.
Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6.
Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °C. В результате получают неон 99,9%-ной чистоты по объёму.
Основным промышленным способом получения неона (в последнее десятилетие) является разделение неоно-гелиевой смеси путём низкотемпературной ректификации — смесь неона и гелия предварительно очищают от примеси азота и водорода (водород выжигают в печи, заполненной катализатором), а азот в низкотемпературных дефлегматорах и в блоке криогенных адсорберов, заполненных активированным углём (уголь охлаждается змеевиками с кипящим в них под вакуумом азотом). После удаления азота неоно-гелиевая смесь сжимается компрессором и поступает в ректификационную колонну (предварительно охлаждаемая до температуры кипящего под вакуумом азота) для разделения. Для понижения температуры охлаждённая смесь дросселируется с 25 МПа до 0,2-0,3 МПа (в зависимости от режима работы установки). В верхней части колонны, из-под крышки конденсатора, отбирается гелий с примесью до 20 % неона, в нижней части колонны в жидком виде получается неон. В качестве холодильного цикла используется дроссельный холодильный цикл с рабочей средой-хладагентом чистым неоном. Ректификационный метод разделения неоно-гелиевой смеси позволяет получить неон чистотой до 99,9999 %.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном. Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер). Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
По традиции «неоновыми» часто называют также разрядные трубки других цветов, в реальности использующие свечение других благородных газов или флуоресцирующего покрытия.
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, а при повышении давления первыми возникают симптомы «неврологического синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Интересные факты
«Неоновые огни» оправдывают своё название только в случае свечения красного цвета. Для получения других цветов используют электрический разряд в парах ртути в газоразрядных трубках, изнутри покрытых люминофором нужного цвета свечения, преобразующих ультрафиолетовое излучение разряда в видимый свет, или разряд в смеси других благородных газов.
Источник: https://formula-info.ru/khimicheskie-formuly/n/formula-neona-strukturnaya-khimicheskaya
Что такое неон? Особенности химического элемента и его свойства как простого вещества :

Химический элемент неон широко распространен во Вселенной, а вот на Земле он считается довольно редким. Тем не менее, его научились получать и без визитов в открытый космос, и теперь его применяют в промышленности, для изготовления радио- и фототехники, а также для глубоководного дайвинга. Что такое неон? Какими свойствами и особенностями он обладает? Об этом мы и поговорим.
Что такое неон?
В Периодической таблице Менделеева этот элемент располагается в восьмой группе под номером десять. Он обозначается символом Ne. В качестве простого вещества он представляет собой одноатомный газ, который не имеет запаха, цвета и вкуса.
Он существует в виде трех изотопов 20Ne, 21Ne и 22Ne, стабильных по своей природе. Чаще всего встречается именно нуклид 20Ne. В атмосфере нашей планеты его распространенность составляет почти 90%, а то время как у изотопа 22Ne – 9,25 %, а у изотопа 21Ne – только 0,27 %.
Последние два изотопа образуются в основном благодаря космическому излучению, которое воздействует на ядра натрия, кремния, алюминия и других элементов. Именно поэтому на Земле они чаще всего присутствуют в воздухе, а не в воде или земной коре. Источник образования на нашей планете Неона-20 до сих пор не известен.
Кроме этих изотопов, известно выделяют около 16 нестабильных нуклидов с периодом распада от 9 зептосекунд до 3,38 минуты.
История открытия
О том, что такое неон, стало известно только в конце XIX века. До этого наука открыла лишь два инертных газа – аргон и гелий, занимающих первый и третий периоды таблицы Менделеева.
При этом место второго периода оставалось пустым, поэтому исследователи предполагали о существовании в природе, как минимум еще одного подобного вещества. В 1997 году шотландский химик Рамзай даже посвятил ему доклад, который так и назывался «Неоткрытый газ».
А уже в следующем году ему посчастливилось обнаружить недостающий элемент.
Чтобы найти его, ученый анализировал гелий и арагон, изучал состав минералов, но успех пришел, когда тот обратился к воздуху.
Он сжижал и медленно испарял газовую смесь, а затем по фракциям пропускал ее через специальную разрядную трубку с электрическим током.
Неоткрытое вещество должно было иметь свойства близкие к гелию, поэтому Рамзай надеялся обнаружить его в самой легкой фракции, которая испарится раньше всего.
Так и произошло. Взаимодействуя с электронами в трубке, первая фракция воздуха начала светиться, и рядом со спектром гелия и аргона ученый увидел и другие линии. Они стали подтверждением того, что существования ранее неизвестного газа. Открытому элементу Рамзай дал греческое название «неон», что в переводе означает «новый».
Свойства
О том, что такое неон, лучше всего судить исходя из его физических и химических свойств. Этот газ является одним из самых легких. Его плотность составляет 0,0089999 г/см³. Закипает он при температуре −246,05 °C, а плавится при −248,6 °C.
Неон практически не реагирует с другими веществами. Он с трудом отдает или присоединяет к себе электроны, поэтому его относят к благородным газам. По инертности с ним может сравниться только гелий. До сих пор не удалось получить ни одного его валентного соединения. Он слабо растворяется в воде, но неплохо адсорбируется активированным углем.
Как и другие благородные газы, он обладает хорошей электропроводностью. Если провести через него ток высокого напряжения – он начнет светиться. В спектре газа насчитывается около 900 линий разных цветов, но самые яркие из них – красные и оранжевые.
Такое свойство неона нашло широкое применение в сфере наружной рекламы. Уже через двенадцать лет после его открытия на улицах стали появляться красные светящиеся вывески с названиями магазинов и кафе.
Первый патент на них оформила компания Claude Neon Lights Inc.
Распространение в природе
Неон, или Ne, можно назвать внеземным газом, ведь в открытом космосе и на других астрономических объектах его гораздо больше, чем на нашей планете. Особенно много его в атмосфере Урана, Нептуна, Сатурна, Юпитера, в туманностях и очень горячих звездах. Кроме того, он содержится в метеоритах и других космических телах.
Во всей Вселенной газ занимает пятое место по распространенности, уступая пальму первенства водороду, гелию, кислороду и углероду. Его содержание по массе составляет примерно 0,13 % по массе.
На Земле он считается редким элементом. В земной коре его содержится около 7·10−9 %, примерно 2·10−8 % — в водах океана и соленых водоемах. Наибольшая концентрация этого химического элемента наблюдается в атмосфере планеты, там его содержание составляет 1,82·10−3 % по объему.
Как его получают?
Из-за небольшой распространенности неона в горных породах и воде, его основным источником является атмосферный воздух. Из него газ получают при помощи сильного охлаждения. При температуре жидкого азота неон кристаллизуется и легко отделяется от гелия, который при этом остается в газообразном состоянии.
Его также получают в качестве побочного продукта, во время добычи из воздуха азота и кислорода. В таком случае, для отделения газа используют адсорбции активированным углем. Для определения неона обычно применяется спектральное излучение или хроматографический анализ.
Сферы использования
Химический элемент неон до сих пор применяется в вывесках и рекламных баннерах, при этом для получения разных цветов его смешивают и с другими веществами. Вместе с гелием он используется при изготовлении лазеров, самостоятельно – для производства фотоаппаратуры.
Жидкий неон обладает лучшей теплоемкостью, чем гелий, и стоит гораздо дешевле. Вместе с водородом его применяют в качестве хладагента для различных холодильных установок.
Криогенные камеры на основе этих газов необходимы в медицине для замораживания живых тканей.
Смесь неона и гелия используется для облегчения состояния пациентов с затруднением дыхания, для этого ее распространяют в комнатах которые наполняют безазотным воздухом.
Источник: https://www.syl.ru/article/399776/chto-takoe-neon-osobennosti-himicheskogo-elementa-i-ego-svoystva-kak-prostogo-veschestva
ПОИСК
 Необходимость выполнения всех этих требований приводит к тому, что в качестве газов-носителей используют довольно ограниченный ассортимент газов гелий, азот, водород, аргон, диоксид углерода, реже воздух, неон, криптон, метан и некоторые другие газы. В последнее время в качестве газа-носителя стали применять водяные пары. [c.59]
Необходимость выполнения всех этих требований приводит к тому, что в качестве газов-носителей используют довольно ограниченный ассортимент газов гелий, азот, водород, аргон, диоксид углерода, реже воздух, неон, криптон, метан и некоторые другие газы. В последнее время в качестве газа-носителя стали применять водяные пары. [c.59]
А + е. Ясно, что при использовании неона в качестве газа-носителя [c.149]
Длина колонки 80 л температура колонки 77,4° К газ-носитель — неон количество пробы 1,5 мкл. [c.329]
Скорость газа-носителя должна быть небольшой, в особенности прн применении дорогостоящих газов (например, гелия или неона). В противном случае недопустимо возрастет стоимость анализа.
В связи с усложнением обслуживания при необходимости частой смены газовых баллонов целесообразно в случае применения другого газа-носителя также работать нри малых скоростях потока.
При изготовлении колонок необходимо принимать во внимание это соображение. [c.378]
В качестве газа-носителя применяется неон, для Сз, Ьи и и — аргон с учетом возможных спектральных помех. [c.887]
Обычно газожидкостное хроматографическое разделение производят в изотермических условиях. Часто также применяют хроматографирование с программированием температуры, осуществляя непрерывное линейное или ступенчатое ее повышение.
Время разделения сложных смесей при этом сокращается, и пики получаются более симметричными. В зависимости от конкретных задач в качестве газа-носителя используют азот, гелий, аргон, углекислый газ, воздух, водород, неон.
Эти газы практически инертны к разделяемым веществам, малорастворимы в неподвижных фазах и незначительно поглощаются сорбентом. [c.74]
При определении неорганических газов в количестве 10 -ь б-Ю г наилучшие результаты были получены при применении неона в качестве газа-носителя с добавкой пара-толуидина в качестве свидетеля между колонкой и детектором. [c.421]
Гелиевый ионизационный детектор. В работе Ловелока было сказано, что, кроме аргона, можно применять и другие редкие газы, если они отвечают требованиям экономичности и чистоты. Как известно, с неоном было проведено немного работ.
Однако Берри [8] недавно опубликовал весьма обнадеживающие результаты с микродетектором, где в качестве газа-носителя использовался гелий, который пропускался через химическую очистительную систему, состоящую из молекулярных сит при —196 и 20° С, титана при 1000° С и гопкалита (смесь окиси меди, кобальта, марганца, серебра) при 400° С.
Получены высокая чувствительность и положительная разрешающая способность для различных соединений в пробе с пределом обнаруживания около 10 молей компонента на 1 мл газа-носителя. [c.17]
К ПРИМЕНЕНИЮ НЕОНА В КАЧЕСТВЕ ГАЗА-НОСИТЕЛЯ В ГАЗОВОЙ ХРОМАТОГРАФИИ [c.64]
Был поставлен вопрос о применении неона в качестве газа-носителя в газовой хроматографии. С самого начала было ясно, что из-за высокой стоимости неон не найдет повсеместного применения. Все же следовало проверить, может ли для специальных целей неон заменить гелий, применяемый широко как газ-носитель. [c.64]
Результаты показывают, что площадь при применении гелия, неона и аргона в качестве газа-носителя увеличивается по сравнению с применением водорода при одинаковой силе тока. Так как температура нити при применении гелия, неона и аргона из-за худшей теплопроводности повышается, увеличивается и чувствительность. [c.66]
Следовательно, неон можно применять для специальных целей в газовой хроматографии в качестве газа-носителя.
Поскольку коэффициенты теплопроводности органических соединений ниже, чем исследованных нами газов, неон может применяться и в высокотемпературной хроматографии.
Некоторые проблемы, не разрешимые при применении водорода из-за соображений безопасности или его активности, могут быть успешно разрешены с помощью неона. [c.66]
Хотя в результатах имеются некоторые противоречия, в этой работе невозможно дать разъяснения по этому поводу. Об этом мы сообщим позднее, после накопления материала.
Полученные результаты показывают своеобразие поведения молекулярных сит.
Особенно заметен тот факт, что значения при применении неона в качестве газа-носителя на молекулярных ситах меньше, чем при других газах. [c.66]
При использовании в качестве газа-носителя гелия и напряжения детектора 1750 е при прочих равных условиях на 100 мл воздуха были получены сигналы для кислорода 2,6 мв и для азота Q,S мв. Следовательно, более высокая чувствительность на приборе Пай соответствует работе с неоном в качестве газа-носителя. [c.67]
Опытные работы, В предварительных опытах была достигнута большая чувствительность для указанных газов при использовании в качестве газа-носителя неона [8]. Опыты велись на покупном аргоновом хроматографе фирмы Пай . Для дальнейших опытов по чертежам д-ра Боте (Институт прикладной радиологии, Лейпциг) был разработан р-ионизационный детектор [9]. [c.69]
В работе в качестве газа-носителя применялись неон—чистота 99,99% (по объему), изготовитель народное предприятие технических газов, Берлин [c.69]
Уже на первых опытах подтвердились наши наблюдения, полученные на приборе Пай , о повышении чувствительности детектора к Нз, Оз, N2 и СН4 при использовании в качестве газа-носителя неона. [c.69]
После некоторых изменений в детекторе (стенки камеры были лучше обработаны) напряжение можно было повысить до 340 в это дало дальнейшее увеличение чувствительности. Так, например, при 30 мл воздуха высота пиков для Од стала — 165 мм и для N3 — 220 мм. При некоторых опытах подводимое напряжение удавалось повысить до 360—380 в.
При этом наблюдалось удивительное явление кислород в пробе воздуха стал давать более высокий ник, чем пик азота. Подобное, но еще более характерное явление наступило при проведении опытов с аргоном в качестве газа-носителя и органическими молекулами, добавляемыми в поток газа-носителя. Вначале это явление нельзя было объяснить.
Можно было предположить, что оно зависит от каких-либо органических молекул. Это явление наблюдалось и после замены газа-носителя аргона на неон. Однако после тщательной промывки детектора восстанавливались обычные соотношения между высотами пиков. Этот эффект имел место лишь при повышении напряжения.
Очевидно, повышение чувствительности для кислорода зависит от подводимого напряжения и органических молекул, вводимых в поток газа-носителя. При введении пробы аргона возможен случай, когда аргон и метан дают обратное отклонение.
В 1 мл сварочного аргона были обнаружены следующие примеси водород, азот и метан, причем последнего — около 10-3%. [c.70]
В этих опытах, как и в опытах с неоном, в качестве газа-носителя, наблюдается более высокая чувствительность для кислорода. [c.71]
Приведенные вьппе результаты охватывают лишь первые опыты с Р-ионизационным детектором. Из результатов, полученных в настоящее время, можно заключить, что чувствительность определения таких газов, как Н2, О2, N2, СН4 с неоном в качестве газа-носителя больше, чем чувствительность определения в случае применения аргона с притоком органических молекул. [c.71]
Гелий и неон можно разделить при температуре жидкого азота на колонке длиной 3 м, наполненной активированным углем. В качестве газа-носителя используют водород. Остальные газы разделяются на активированном угле и при нормальной температуре. [c.116]
В зависимости от конкретных условий проведения процесса, в качестве газа-носителя обычно используют азот, гелий, аргон, двуокись углерода, воздух, водород и, реже, неон.
Все перечисленные газы практически инертны к разделяемым веществам и сорбентам, за редкими исключениями (гидрирование олефинов при каталитическом действии стенок колонки или твердого носителя, восстановление нитрата серебра, раствор которого может использоваться в качестве неподвижной жидкости). [c.56]
В аналогичном детекторе несколько иной конструкции в качестве газа-носителя используют гелий или неон.
Поскольку в этих газах всегда присутствуют примеси, они ионизируются, а так как потенциал возбуждения атомов гелия и неона очень велик, перманентные газы, Рис. Ill, 13.
Количественная находящиеся в элюате даже в не-(а) и качественная (б) хрома- больших количествах, резко умень- [c.178]
Гелиевый детектор. Разработан для ультрамикроанализа газов. Под воздействием тритиевого источника р-излучения и высокого градиента электрического поля (более 2000 В/см) гелий, используемый в качестве газа-носителя, переходит в метастабильное состояние с определенным ионизационным потенциалом.
Все соединения с более низким потенциалом ионизации при этом ионизируются и дают положительный сигнал. Гелиевый детектор дает отклик на все газы, исключая неон. Этот детектор удобен для анализа следовых примесей в высоко очищенных этилене, кислороде, аргоне, водороде, диоксиде углерода и т. д. [c.
233]
Как следует из выражения (2.9), коэффициент диффузии в газовой фазе входит и в числитель, и в знаменатель выражения, определяющего высоту, эквивалентную-теоретической тарелке.
Обычно в газах с малой плотностью, например в водороде, гелии и неоне, коэффициент диффузии хроматографируемых веществ выше, чем в газах с большей плотностью, например в азоте, аргоне, диоксиде углерода.
Следовательно, при больших рабочих скоростях, когда высота, эквивалентная теоретической тарелке, определяется членом Са, целесообразнее использовать газ-носитель с малой плотностью, поскольку с увеличением абсолютное значение члена Со уменьшается. При малых рабочих скоростях справедливо обратное.
Необходимо иметь в виду, что, согласно выражению (2.30), снижение коэффициента диффузии [6,7] приводит к уменьшению Ыор1> так что повышение эффективности колонки до максимальной приводит к увеличению длительности анализа. [c.31]
Гелий, есмотря на сравнительно высокую стои.мость, широко используется в хроматографии как газ-носитель. Его теплопроводность лишь немногим меньше, чем у водорода, чувствительность катарометра на этом газе в среднем на порядок выше, чем на азоте.
Гелий также используется в ионизационных детекторах для определеиия микропри.месей перманентных газов. Так как гелий по сравнению с аргоном имеет значительно более высокий уровень энергии метастабильных атомов, все перманентные газы могут быть ионизированы.
Однако для этих целей требуется высокочистый гелий. Поэто.му газовые линии прибора должны быть полностью свободными от течей, так как любые примеси, кроме неона, увеличивают фоновый ток гелиевого детектора.
Даже ультрачистый гелий, содержащий менее 10 ppm примесей, нуждается в дополнительной очистке. [c.15]
Коэффициенты теплопроводности наиболее употребляемых газов-носителей следующие (А, в пал1см X 10 ) водород — 40,0 гелий — 33,6 неон — 10,9 аргон — 4,0 азот — 5,68. Из приведенных данных видно, что применение неона обосновано, хотя теплопроводность его в три раза меньше, чем теплопроводность гелия.
Однако неон имеет большую вязкость (rj в г см X 10 ) водород — 88 гелий — 194 неон — 312 аргон — 222 азот — 175. Обычно стремятся использовать газ-носитель, обладающий малой вязкостью. Падение давления в коротких колонках не имеет большого значения, в длинных колонках это падение давления делается весьма заметным.
[c.64]
Иной способ был описан Крейчн и Янаком , которые смесь кислород—аргон пропускали над палладием, нанесенным на алюмокальциевый силикат, при этом кислород 8 присутствии водорода связывался в воду. Порядок вымывания на кальциевом цеолите следующий гелий+неон, кислород+аргон, азот, метан и т. д. В качестве газа-носителя был использован водород. [c.115]
Исследования поведения электронов в других благородных газах показали наличие малой положительной длины рассеяния для неона и, по-видимому, существование отталкивания в случае более тяжелых элементов.
Токи ионизации и подвижности носителей заряда измерялись во многих неполярпмх растворителях, но характер отих носителей в большинстве случаев неясен только в гелии и, возможно, в жидких водороде и неоне можпо просто исключить примеси электронных ловушек. [c.132]
Газовая хроматография обеспечивает уникальные возможности определения изотопов и спиновых изомеров водорода. Так, для разделения Иг, НО и Вг могут быть использованы молекулярное сито 5А при температуре жидкого азота, активный оксид алюминия, адсорбент, содержащий оксид алюминия и СГ2О3 или оксид алюминия и РегОз. Газами-носителями служат гелий и неон. [c.222]
Анализ водорода, дейтерия и трития проводят на низкотем-ператз рных колонках с молекулярным ситом, а также на колонке с палладиевой чернью, нанесенной на асбест. Разделение смеси дейтероводорода и спиновых изомеров водорода и дейтерия осуществили Монке и Зафферт [232].
Они использовали стеклянную капиллярную колонку с внутренним диаметром 0,27 мм, обработанную водным раствором а ммиака и кондиционированную при 170 °С в течение 70 ч. Длина колонки 80 м, температура разделения —196 °С, расход газа-носителя (неона) [c.
222]
Гиддингс20 считает, что при проведении анализа с максимальной скоростью существенную роль играет отношение коэффициента диффузии D к динамической вязкости газа г. Поэтому при скоростном анализе наилучшим газом-носителем является водород, для которого это отношение минимально. Затем следуют гелий, азот, неон, двуокись углерода и, наконец, аргон. [c.67]
Источник: https://chem21.info/info/40101/
Неон

Неон (лат. Neonum), Ne, химический элемент VIII группы периодической системы Менделеева, относится к инертным газам, атомный номер 10, атомная масса 20,179. На Земле присутствует главным образом в атмосфере, содержание Неона в которой оценивается в 7,1·1011 т.
В 1 м3воздуха находится около 16 см3 Неона. Атмосферный Неон состоит из смеси трех стабильных изотопов: 20Ne, 21Ne и 22Ne; преобладает 20Ne (90,92%). Неон открыт в 1898 году английскими учеными У. Рамзаем и M.
Траверсом при исследовании легколетучей фракции жидкого воздуха; название происходит от греческого neos — новый.
При обычных условиях Неон — газ без цвета и запаха. При 0°C и 760 мм рт. ст.
(101 кн/м2) плотность Неона 0,900 г/л, tпл -248,6 °C, tкип (при 101 кн/м2) -245,9 °C, растворимость в воде 10,4 мл/л; кристаллическая решетка твердого Неона кубическая; параметр а элементарной ячейки равен 4,52 Å при -253 °C.
Молекула Неон одноатомна. Внешняя электронная оболочка атома Неона содержит 8 электронов и очень устойчива; химические соединения Неон еще не синтезированы.
Получают Неон при разделении воздуха. Применение Неона связано главным образом с электротехнической промышленностью. Лампы, заполненные Неоном, дающие красное свечение, используют в портах, на аэродромах и т. д. Жидкий Неон начинают применять для получения низких температур.
Практическое применение неону нашли не сразу. Кроме научных лабораторий, занимавшихся его изучением, первыми открыли свойства неона специалисты в сфере электровакуумной промышленности. Однако им требовалось весьма небольшое количество этого газа, для производства которого хватало маломощных установок.
Даже при нынешнем, развитии технологий из 4080 тысяч кубометров воздуха получают всего 320 литров неона, сжатого под давлением 150 атмосфер.
Таким образом, в наши дни спрос на неон существенно превышает возможности его производства. Неон активнейшим образом применяется в криогенной технике в качестве охлаждающего агента.
Поскольку жидкий неон не взрывается и весьма мало испаряется, он хранится в криостатах по много месяцев. С его помощью, к примеру, хранят ракетное топливо, замораживают животные ткани.
С помощью неона в термобарокамерах осуществляется имитация условий открытого космоса.
Смесь неона, гелия и кислорода – основной компонент так называемого искусственного, безазотного воздуха, которым дышат водолазы, пассажиры глубоководных аппаратов, которым по причине пребывания в условиях высокого давления необходимо уберечься от азотной эмболии (кессонной болезни), а также люди с заболеваниями дыхательных органов.
Общеизвестно, что неон является газом, порождающим свет. Каждый вечер жители городов видят на улицах большое количество неоновой рекламы, магазинных вывесок. Изготовление неоновых вывесок, светящихся и днем и ночью, сегодня выросло в отдельную, крупную отрасль рекламной промышленности.
Газосветные неоновые трубки еще очень долго будут использоваться – по крайней мере, до тех пор, пока не удешевится технология производства светодиодных светильников, высокая стоимость которых сегодня отпугивает очень многих потенциальных покупателей.
И уж точно неоновые трубки будут вечно популярны при изготовлении высокохудожественных, уникальных дизайнерских изделий, предметов интерьера.
Неон используется в высококачественных осветительных лампах, когда применение недорогого аргона является недостаточным. Лампы заправляют неоно-гелиевой смесью, с малым добавлением аргона, который способствует уменьшению напряжения зажигания.
Такие лампы, дающие мощный, красно-оранжевый свет, видны издалека даже сквозь туман. Нетрудно догадаться, что по этой причине неоновые лампы применяются на маяках.
С их помощью в темноте обозначаются габариты небоскребов, телевизионных вышек, границы взлетных полос и аэродромов.
Что касается применения в радиоэлектронной промышленности, то неон, а также прочие тяжелые инертные газы, используют для фотоэлементов, работающих на газе. Такими газами заполняются электровакуумные ионные устройства – тиратроны (реле сверхбыстрого действия).
Небольшие газоразрядные приборы, размером приблизительно 1,5х1,5 сантиметра, давно и успешно пришли на замену расходующим много электроэнергии и недолговечным радиолампам, а также полупроводникам, которые слишком чувствительны к резким температурным перепадам.
Источник: https://himiya.gosstandart.info/himicheskie-elementy/inertnye-gazy/neon/
Инертные газы: гелий, неон, аргон, криптон, ксенон и радон

Каждый период Периодической системы заканчивается инертным газом, кроме гелия, все они имеют на внешнем энергетическом уровне по 8 электронов, образующих очень устойчивую систему, в связи с чем эти элементы получили название инертных.
Несмотря на то, что электронная оболочка гелия состоит из двух электронов, она также очень устойчива.
В связи с этим явлением атомы инертных газов обладают высокими значениями энергий ионизации и, как правило, отрицательными значениями энергии сродства к электрону.
Электронная конфигурация внешнего энергетического уровня инертных газов – 1s2 (He) и ns2np6 для других инертных газов.
Изначально предполагали, что атомы инертных газов не способны к образованию химических связей с другими элементами. Были известны лишь несколько нестойких соединений благородных газов – гидраты аргона, криптона и ксенона (Ar×6H2O, Kr×6H2O, Xe×6H2O), которые получались при действии инертных газов на кристаллизующуюся переохлажденную воду.
Позже, было установлено, что Kr, Xe и Rn вступают в реакции взаимодействия с другими веществами, например, с фтором, при нагревании или электрическом разряде. Для ксенона известны оксид – XeO3 и гидроксид- Xe(OH)6.
Наибольшее практическое применение среди всех благородных газов находят аргон, неон и гелий.
Гелий
По физическим свойствам гелий наиболее близок к молекулярному водороду. В связи с малой поляризуемостью атома гелия, у него самые низкие температуры кипения и плавления, по сравнению с другими элементами VIIIA группы. Однако, он хуже, чем другие инертные газы растворим в воде.
В обычных условиях гелий химически инертен, но в возбужденном состоянии он способен образовывать неустойчивые молекулярные ионы He2+ или ионизированные молекулы HeH+.
Гелий – наиболее распространенный из элементов космоса, после водорода и состоит из двух изотопов — 4He и 3He. Доказано присутствие гелия в атмосфере Солнца, звезд и в метеоритах.
Гелий получают из некоторых природных газов методом глубокого охлаждения, при этом гелий остается в газообразном состоянии, в то время как другие газы конденсируются.
Гелий нашел применение в атомной энергетике, при автогенной сварке металлов, в физических лабораториях в качестве хладоносителя. Изотоп гелия 3 He – единственное вещество, пригодное для измерения температур ниже 1К.
Неон. Аргон
Основное отличие неона от гелия – большая поляризуемость атома, склонность к образованию межмолекулярных связей, несколько большая растворимость и способность адсорбироваться.
Агрон, как и неон, имеет 8 электронов на внешнем энергетическом уровне и, вследствие высокой устойчивости электронной структуры атома неона, он не способен к образованию соединений валентного типа.
Аргон образует молекулярные соединения включения – клатраты – с водой, фенолом, толуолом и другими веществами. С сединениями H2S, SO2, CO2, HCl аргон дает двойные гидраты, т.е. смешанные клатраты.
Неон и аргон получают из воздуха путем его разделения при глубоком охлаждении. Аргон, в связи с его сравнительно высоким содержанием в воздухе, получают в значительных количествах, неон – в меньших.
Неон и аргон применяют в качестве наполнителей ламп накаливания, газосветных трубок (для неона характерно красное свечение, для аргона – сине-голубое). Аргон, как наиболее доступный из инертных газов, используют в металлургии, в частности при аргонно-дуговой сварке алюминиевых и алюминиевомагниевых сплавов.
Подгруппа криптона
Энергия ионизации элементов подгруппы криптона (Kr, Xe, Rn) характеризуются меньшими значениями энергии ионизации, чем типические элементы VIIIA группы, поэтому могут образовывать соединения обычного типа. Так, ксенон может проявлять степени окисления «+2», «+4», «+6», «+8».
Криптон применяют в электровакуумной технике, в смеси с ксеноном его используют в качестве наполнителя для различного вида осветительных ламп и трубок. Радиоактивный радон используют в медицине.
Примеры решения задач
Источник: https://ru.solverbook.com/spravochnik/ximiya/9-klass/inertnye-gazy/
Неон (Ne) по ТУ 6-21-9-78

Данное оборудование указано в следующих разделах каталога:
- Чистые газы, технические газы
Неон — инертный газ, содержащийся в воздухе в микроскопических количествах.
Неон также есть в природном газе, в горных породах, некоторых полезных ископаемых, в космосе. Получают неон из неоногелиевой смеси методом криогенной низкотемпературной ректификации.
Неон применяют в светотехнике, рекламе и электровакуумной промышленности, космической и химической промышленности, электронике, в качестве рабочего вещества в эксимерных лазерах, как хладагент в криогенной промышленности и в составе газовых смесей различного назначения. Жидкий неон используется в космических исследованиях как охладитель для формирования ультрачувствительного инфракрасного изображения и аппаратуры систем обнаружения.
Неон — одноатомный газ, бесцветный, без запаха и вкуса, не токсичный, химически инертный. Неон неактивный газ и не вступает в реакции ни с какими химическими элементами в обычных условиях. В жидком виде неон — после гелия и водорода — является наиболее низкокипящей (-246 °С) и трудно замерзающей (-249 °С) жидкостью.
Неон не токсичен, не горюч, не взрывоопасен. При высоких концентрациях в воздухе вызывает состояние кислородной недостаточности и удушье. При попадании в глаза осторожно промыть водой в течение 15 минут.
Технические характеристики
| Техническое наименование | неон газообразный |
| Химическая формула | Ne |
| Номер по списку ООН | 1065 |
| Класс опасности при перевозках | 2.
1 |
| Физические свойства | Физическое состояние при нормальных условиях | газ |
| Плотность при нормальных условиях (101,3 кПа, 20 °C), кг/м³ | 0,838 | |
| Температура кипения при 101,3 кПа, °С | -245,9 | |
| Температура тройной точки, °С и равновесное ей давление (мПА) | -248,6 (0,0433) | |
| Растворимость в воде | незначительная | |
| Пожаро- и взрывоопасность | пожаро-взрывобезопасен | |
| Стабильность и химическая активность | Стабильность | стабильный |
| Реакционная способность | инертный газ | |
| Температура воспламенения, °С | с воздухом | |
| с кислородом | ||
| Пределы воспламенения, объемные доли, % газа | с воздухом | |
| с кислородом | ||
| Опасность для человека | ПДК, мг/м³ | |
| Токсическое воздействие | не токсичен | |
| Экологическая опасность | не оказывает влияния на окружающую среду | |
| Средства пожаротушения | допустимы любые средства пожаротушения |
Требования к составу
| Содержание примесей, % об., не более, в том числе | гелий | 0.00008 |
| азот | 0.0001 | |
| кислород | 0.00005 | |
| метан | 0.
000001 |
|
| влага | 0.0001 | |
| водород | 0.00005 |
Неон газообразный перевозят в стальных баллонах (ГОСТ 949-73) черного цвета под давлением 150 атм. при 20 °С.
Баллоны должны иметь латунные мембранные вентили типа КВБ-53М.
Баллоны, наполненные неоном газообразным, перевозятся всеми видами транспорта, предназначенными для перевозки сжатых газов.
Источник: https://granat-e.ru/neon.html