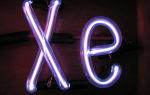geliygas.ru | продажа гелия оптом и в розницу
Гелий – газ с разнообразной палитрой применения!
Вы запланировали покупку благородного газа, но не имеете представления, где купить гелий в Крыму?
Гелий относится к группе одноатомных газов, его также именуют благородным газом, не имеющим в своих свойствах ни цвета, ни вкусовых качеств, ни запаха.
Также, большим плюсом купить гелий будет то, что это вещество максимально безопасно: благодаря своим свойствам он не поддаётся возгоранию, а также его советуют за минимальное содержание токсинов, которые могут очень сильно навредить общему состоянию Вашего здоровья. Применение этого газа в Крыму имеет широкую палитру. Гелий относят к веществам, являющим собой источник достижения низких температур и используется в физических и химических сферах.
Наиболее частотной причиной, по которой приходят к решению купить гелий в Крыму, является наполнение им воздушных шаров. Эта сфера получила большую популярность и её неразрывно связывают с применением данного вещества. Важно, что для этого используется лишь газообразное состояние.
При смешении этого благородного газа с Н2 выводят смесь для наполнения дирижаблей.
С медицинской точки зрения, такое вещество очень плохо растворимо в крови. В Крыму с этим связано решение купить гелий для погружений под воду ( дайвинг – сфера обширного применения этого газа в Крыму). Также, приобрести такого рода товар нужно компаниям, которые занимаются созданием подводных строений: это всё также связано с медицинскими критериями.
Гелий Вам поможет, если Вы страдаете от разного рода заболевания дыхательных путей, таких как, например, астма.
В Крыму часто покупают благородное вещество для того, чтобы в дальнейшем использовать его в сфере металлургии. Он применяется для выплавки металлов, исполняя роль газа с защитной функцией.
Если Вы связаны с пищевой промышленностью в Крыму, то купить гелий для Вас – очень выгодное решение, ведь его используют уже долгое время в качестве пищевой составляющей.
Купить Не в Крыму можно для того, чтобы выявлять утечки в трубопроводах.
Если Вы заинтересованы в успешном ведении дел в одном из вышеперечисленных направлений, то купить этот газ будет выгодным решением!
Сколько шаров в одном гелиевом баллоне
Давайте разберемся на сколько же шаров хватит одного гелиевого баллона. Для начала нам стоит определиться, какие у нас шары и какой баллон мы будем использовать, 10 литровый или большой 40 литровый.
Геливые баллоны изготавливаются по ГОСТ 949-73 и предусматривают рабочее давление в них 150 АТМ, то есть 10 литровый баллон будет иметь 10*150=1500 литров, а 40 литровый 40*150=6000 литров, при полном заполнении баллонов. Дальше Вам нужно выяснить объем заполнения в литрах, гелиевого шарика и разделить на общее кол-во гелия в баллоне.
Например 9 дюймовый шарик или 25 см вмещает в себя 7,5 литров и несложно посчитать на сколько таких шаров хватит одного гелиевого 40 литровго баллона 6000/7,5=800 штук.
Ниже приведем таблицу уже расчитаного кол-во шаров для двух баллонов 10 и 40 литров, а так же примерное время полета шара. У вас значения могут незначительно отличаться на +20%, все зависит от наполненности шара гелием.
Таблица количества шаров в гелиевых баллонах
| Размер шара | Гелиевый баллон, 40 л. | Гелиевый баллон,10 л. | Время полета шара |
| 9″ 25 см | 750-800 шт. | 160-170 шт. | 8-12 часов |
| 12″ 30 см | 450-500 шт. | 100-120 шт. | 12-18 часов |
| 18″ 45 см.фольга | 180-200 шт. | 30-40 шт. | 2-3 недели |
Источник: http://geliygas.ru/
Гелий
ГЕЛИЙ, He (лат. Helium, от греч. helios — Солнце, т. к. впервые был обнаружен в солнечном спектре * а. helium; н. Helium; ф. helium; и. helio), — элемент VIII группы периодической системы Менделеева, относится к инертным газам, атомный номер 2, атомная масса 4,0026.
Природный гелий состоит из двух стабильных изотопов 3He и 4He. Открыт в 1868 французким астрономом Ж. Жансеном и английским астрономом Дж. Н. Локьером при спектроскопическом исследовании солнечных протуберанцев. На Землегелий впервые выделен в 1895 английским физиком У.
Рамзаем из радиоактивного минерала клевеита.
Свойства гелия
При нормальных условиях гелий — газ без цвета и запаха. Плотность 0,178 кг/м3, t кипения — 268,93° С. Гелий — единственный элемент, который в жидком состоянии не отвердевает при нормальном давлении, как бы глубоко его ни охлаждали. В 1938 советский физик П. Л. Капица открыл у 4He сверхтекучесть — способность течь без вязкости.
Наименьшее давление, необходимое для перевода жидкого гелия в твёрдый, 2,5 МПа, при этом t плавления — 272,1°С. Теплопроводность (при 0°С) 2,1•10-2 Вт/м•К.
Молекула гелия состоит из одного атома, её радиус от 0,085 (нетинный) до 0,133 нм (Ван-дер-Ваальсов) (0,85-1,33 Е), В 1 литре воды при 20°С растворяется около 8,8 мл гелия Устойчивые химические соединения гелия не получены.
Гелий в природе
По распространённости во Вселенной гелий занимает 2-е место после водорода. На Земле гелия мало: в 1 м3 воздуха содержится 5,24 см3 гелия, среднее содержание в литосфере 3•10-7%. В пластовых флюидах литосферы существуют 3 генетические составляющие гелия — радиогенный, первозданный и атмосферный гелий.
Радиогенный гелий образуется повсеместно при радиоактивных превращениях тяжёлых элементов и различных ядерных реакциях, первозданный — поступает в литосферу как из глубинных пород мантии, окклюдировавших первозданный гелий и сохранивших его со времени формирования планеты, так и из космоса вместе с космической пылью, метеоритами и т.п.
Атмосферный гелий попадает в осадки из воздуха, при процессах седиментогенеза, а также с инфильтрующимися поверхностными водами.
Величина отношения 3He/4He в радиогенном гелии земной коры составляет п•10-8, в гелии мантии (смеси первозданного и радиогенного) (3±1)•10-5, в космическом гелии 10-3-10-4, в атмосферном воздухе 1,4•10-6. В земном гелии абсолютно преобладает изотоп 4He.
Основное количество 4He образовалось при а-распаде естественных радиоактивных элементов (радиоизотопы урана, актиноурана и тория). Незначительные источники образования 4He и 3He в литосфере — ядерные реакции (нейтронное расщепление лития и т.п.), распад трития и др.
На древних стабильных участках земной коры преобладает радиогенный 4He3He/4He = = (2±1)•10-8. Для тектонически нарушенной земной коры (зон рифтов, глубинных разломов, эруптивных аппаратов, с тектономагматической или сейсмической активностью и т.п.) характерно повышенное количество 3He 3He/4He = n•10-5.
Для остальных геологических структур отношение 3He/4He в пластовых газах и флюидах изменяется в пределах 10-8-10-7. Различие в величинах изотопно-гелиевых отношений 3He/4He в мантийном и коровом гелии является индикатором современной связи глубинных флюидов с мантией.
В силу лёгкости, инертности и высокой проницаемости гелия большинство породообразующих минералов его не удерживает, и гелий мигрирует по трещинно-поровым пространствам пород, растворяясь в заполняющих их флюидах, иногда далеко отрываясь от основных зон образования.
Гелий — обязательная примесь во всех газах, образующих самостоятельные скопления в земной коре или выходящих наружу в виде естественных газовых струй.
Обычно гелий составляет ничтожную примесь к другим газам; в редких случаях его количество доходит до нескольких % (по объёму); максимальные концентрации гелия выявлены в подземных газовых скоплениях (8-10%), газах урановых шахт (10-13%) и водорастворённых газах (18-20%).
Получение гелия
В промышленности гелий получают из гелийсодержащих газов методом глубокого охлаждения (до -190°С), незначительное количество — при работе воздухоразделительных установок. Основные газовые компоненты при этом конденсируются (вымораживаются), а оставшийся гелиевый концентрат очищается от водорода и неона. Разрабатываются также диффузные методы извлечения гелия.
Транспортировка и хранение гелия — в высокогерметизированных ёмкостях. Гелий 1-2-го сортов обычно перевозят в стальных баллонах разной ёмкости, чаще до 40 л, под давлением до 15 МПа.
Хранилища гелия устраивают также в подземных соляных камерах, а гелий-сырец (около 60% He и 40% N2) хранят в выработанных подземных газовых структурах.
На дальние расстояния гелий поставляется в сжатом и жидком виде с помощью специально оборудованного транспорта, а также газопроводом (например, в США).
Использование гелия
Применение гелия основано на таких его уникальных свойствах, как полная инертность (сварка в атмосфере гелия, производство сверхчистых и полупроводниковых материалов, хроматография, добавка в дыхательные смеси и пр.
), высокая проницаемость (течеискатели в аппаратах высокого и низкого давлений). гелий — единственный из химических элементов, который позволяет получать сверхнизкие температуры, необходимые для всех типов сверхпроводящих систем и установок (криоэнергетика).
Жидкий гелий — хладоагент при проведении научных исследований.
Источник: http://www.mining-enc.ru/g/gelij
Газ Гелий — Каталог статей |
Выберети ваш город
Заявка принята
Мы свяжемся с вами как можно скорее
Главная / О гелие / Гелий: как его добывают и где применяют
Гелий: как его добывают и где применяют
Гелий – это инертный газ без цвета и запаха, химический элемент, внесенный в периодическую систему. Первое упоминание о гелии относят к 1868 году.
Тогда исследователи Пьер Жюль Жансен и Джозеф Норман Локьер наблюдали за солнечным затмением и проводили спектроскопию лучей.
При разделении солнечных лучшей на элементы разного цвета они заметили светло-желтый элемент, до этого неизвестный физикам. Позже выяснилось, что это и был гелий.
Несмотря на то, что гелий занимает второе место по количеству во вселенной после водорода, на Земле он встречается нечасто. Только в 1895 году ученым из Шотландии удалось выделить это вещество из клевеита – природного минерала.
Месторождения гелия
Сегодня гелий добывают в недрах земли, выделяя его из природного газа. В России его добычей занимается завод по обработке газа в Оренбурге.
Природный газ, с которым работают на заводе, содержит всего 0,055% гелия, что считается очень небольшим показателем. Газы, богатые гелием – это газы, в которых его содержание составляет не менее 0,5%.
Если природный газ содержит от 0,1 до 0,5% гелия, его называют родовым гелиевым месторождением.
В общей сложности на Земле насчитывается более 40 миллиардов кубометров гелия. Больше всего богаты на гелий Китай, Россия, США, Алжир, Катар.
Ежегодно по всему миру добывается около 175 миллионов кубических метров гелия. Российские месторождения добывают всего 5 млн кубометров.
В Сибири и на Дальнем Востоке обнаружены богатые месторождения этого газа, однако на сегодня его добыча там не налажена.
Как получают гелий из природного газа
Процесс получения гелия состоит из двух этапов. Вначале природный газ охлаждают, после чего происходит конденсация и выделяется гелиевый концентрат – вещество, которое на 80% состоит из гелия. После этого полученное вещество очищают от примесей (водорода, аргона, метана, азота). Для очищения используются различные методы.
Где применяется гелий
Этот инертный газ отлично проводит электричество и тепло, поэтому широко применяется во многих сферах – в ракетостроении, авиации, атомной промышленности, медицине. Он намного легче воздуха, поэтому его используют также в воздухоплавании и подводных погружениях.
Этот газ входит в состав дыхательных смесей – он не токсичен, его можно вдыхать без вреда для здоровья.
Совсем недавно ученые открыли еще одну область применения гелия – в атомной индустрии. Гелий используется как теплопроводник для атомных реакторов. В металлургии этот газ используют как защитное вещество при сварочных работах.
Запасы гелия на Земле
По оценкам экспертов, чтобы удовлетворить такие большие потребности в гелии, к 2030 году ежегодно будет требоваться 238-312 миллионов кубометров. К этому времени объем добычи возрастет всего лишь до 213-238 млн.
кубических метров за год, поэтому ожидается некоторая нехватка гелия в производственных сферах. Выход из этой ситуации один – повышать количество добываемого гелия.
В России уже сегодня строятся новые предприятия по его добыче – преимущественно в регионах Сибири.
Информация на сайте носит ознакомительный характер и не является публичной офертой.
+7 (812) 989-88-18
+7 (812) 906-11-36
Мы в социальных сетях
Источник: http://www.heliy.ru/publ/gelij_kak_ego_dobyvajut_i_gde_primenjajut/1-1-0-5
Способы получение гелия
Существует три основных источника получения гелия:
- из гелийсодержащих природных газов
- из минералов
- из воздуха
Получение гелия из природного газа
Основным способом получения гелия является метод фракционной конденсации из природных гелийсодержащих газов, т.е. методом глубокого охлаждения.
Причем используется его характерное свойство — наиболее низкая по сравнению с известными веществами температура кипения. Это позволяет конденсировать все сопутствующие гелию газы, прежде всего метан и азот.
Процесс осуществляется обычно в две стадии:
- выделение так называемого сырого гелия (концентрата, содержащего 70-90% He)
- очистка с получением технически чистого гелия.
На рисунке ниже приведена одна из схем установки для извлечения гелия из природного газа.
Схема установки для извлечения гелия из природного газа
Газ сжимается до 25 атмосфер и под этим давлением поступает в установку.
Очистка от углекислого газа (CO2) и частичная осушка газа производятся в скрубберах, которые орошаются раствором, содержащим 10-20% моноэтаноламина, 70-80% диэтиленгликоля и 5-10% воды.
После скрубберов в газе остается 0,003-0,008% углекислоты CO2, а точка росы не превышает 5°С. Дальнейшая осушка осуществляется в адсорберах с силикагелем, где достигается температура точки росы -45°С.
Под давлением около 20 атмосфер чистый сухой газ поступает в предварительный теплообменник 1, где охлаждается до -28° С обратными газовыми потоками. При этом происходит конденсация тяжелых углеводородов, которые отделяются в сепараторе 2.
В аммиачном холодильнике 3 газ охлаждается до -45°С, конденсат отделяется в сепараторе 4. В основном теплообменнике 5 температура газа снижается до -110°С, в результате чего конденсируется значительная часть метана.
Паро-жидкостная смесь (около 20% жидкости) дросселируется до давления 12 атмосфер в первый противоточный конденсатор 6, на выходе из которого паро-газовая смесь обогащается гелием до 3%.
Образовавшийся в трубках конденсат стекает в отпарную секцию, на тарелках которой из жидкости удаляется растворенный в ней гелий, присоединяющийся к паро-газовому потоку.
Жидкость дросселируется до 1,5 атмосфер в межтрубное пространство конденсатора, где служит хладагентом. Образовавшийся здесь пар выводится через теплообменники 5 и 1.
Паро-газовая смесь, выходящая из конденсатора 6 и содержащая до 3% He, под давлением 12 атмосфер идет во второй противоточный конденсатор 7, состоящий из двух частей: в нижней части находится змеевиковый теплообменник, в трубках которого испаряется сдросселированная с 12 до 1,5 атмосфер кубовая жидкость, а в верхней части — прямотрубчатый теплообменник, в межтрубном пространстве которого кипит азот при температуре -203°С и давлении 0,4 атмосферы. В результате конденсации компонентов газовой смеси в нижней части аппарата 7 газ обогащается гелием до 30-50%, а в верхней части — до 90-92%.
Сырой гелий такого состава под давлением 11-12 атмосфер поступает в теплообменники, где нагревается и выводится из установки. Так как в природном газе содержатся небольшие примеси водорода, то в сыром гелии концентрация водорода увеличивается до 4-5%.
Удаление водорода производят каталитическим гидрированием с последующей осушкой газа в адсорберах с силикагелем.
Сырой гелий сжимается до 150- 200 атмосфер мембранным компрессором 8, охлаждается в теплообменнике 9 и поступает в прямоточный змеевиковый конденсатор 10, охлаждаемый азотом, кипящим под вакуумом.
Конденсат (жидкий азот) собирается в сепараторе 11 и периодически выводится, а несконденсировавшийся газ, содержащий примерно 98% He идет в адсорбер 12 с активированным углем, охлаждаемым жидким азотом. Гелий, выходящий из адсорбера, содержит примесей менее 0,05% и поступает в баллоны 13 в качестве продукта.
Особенно богаты гелием природные газы в США, что определяет широкое применение гелия для сварки в этой стране.
Получение гелия из минералов
Другим источником гелия являются некоторые радиоактивные минералы содержащие уран, торий и самарий:
- клевеит
- фергюсонит
- самарскит
- гадолинит
- монацит
- торианит
В частности монацитовые пески, крупное месторождение которых имеется в Траванкоре (Индия): монациты этого месторождения содержат около 1 см3 гелия в 1 г руды.
Для получения гелия из моноцита необходимо нагреть в закрытом сосуде моноцит до 1000°С. Гелий выделяется вместе с углекислым газом (CO2), который затем поглощался раствором едкого натрия (NaOH). Остаточный газ содержит 96,6% He.
Дальнейшая очистка производится при 600°С на металлическом магнии для удаления азота, а затем при 580°С — на металлическом кальции для удаления оставшихся примесей. Продукционный газ содержит свыше 99,5% He. Из 1000 т монацитового песка можно получить около 80 м3 чистого гелия.
Такой способ получения гелия не представляет технического и промышленного интереса..
Получение гелия из воздуха
В небольшом количестве гелий находится в воздухе, из которого он может быть получен в качестве побочного продукта при производстве кислорода и азота из воздуха, описанного в статье «Азот — безжизненный газ, который так необходим для жизни». В промышленных ректификационных колоннах для разделения воздуха над жидким азотом собирается остающаяся газообразной смесь неона и гелия. На рисунке ниже показан аппарат Клода, специально приспособленный для отделения такой смеси.
Аппарат Клода для выделения неона и гелия из воздуха
Газ, выходящий из аппарата через вентиль Д, охлаждается в змеевике S, который поливается жидким азотом из Т, чтобы сконденсировать остаточный азот. Если вентиль R немного открыть, получается смесь, содержащая очень мало азота.
При таком методе промышленного получения гелия, кроме трудности, заключающейся в необходимости обработать большое количество воздуха, встречается еще дополнительное затруднение — необходимость отделения гелия от неона.
Это отделение может быть выполнено с помощью жидкого водорода, в котором неон отвердевает, или с помощью адсорбции неона активированным углем, охлаждаемым жидким азотом.
Получение гелия из воздуха нецелесообразно вследствие его малого количества — 0,00046% объема или 0,00007% веса. Расчеты показывают, что стоимость одного кубометра гелия, добытого из воздуха, будет в тысячи раз больше, чем при добывании его из природных газов. Такая высокая стоимость, конечно, исключает возможность промышленного выделения гелия из воздуха.
Источник: http://weldering.com/sposoby-poluchenie-geliya
Газ гелий
Гелий – химический элемент с атомным номером 2 в периодической системе химических элементов Д.И. Менделеева. Химическая формула Не. Гелий – инертный газ без цвета и запаха.
Гелий очень распространён во Вселенной. Он занимает второе место после водорода. Но на Земле гелия мало.
Гелий не вступает в реакцию ни с одним химическим элементом. Его атомы не соединяются даже между собой. Гелий не горит.
Открытие гелия
Открыли гелий в 1868 г. во время солнечного затмения. Причём, сделано это открытие одновременно двумя астрономами – французом Пьером Жюлем Жансеном и англичанином Джозефом Норманом Локьером.
В спектре солнечной короны оба независимо друг от друга обнаружили жёлтую линию, которая не принадлежала ни одному их известных в то время элементов. Локьер в 1871 г. предположил, что на Солнце присутствует новый химический элемент. А в 1895 г.
шотландский химик Уильям Рамзай впервые выделил газ из радиоактивного минерала клевеита. В спектре этого газа присутствовала точно такая же жёлтая линия. Новому элементу дали имя Helios – солнце.
Получение гелия
Гелий получают из природных гелионосных газов методом глубокого охлаждения. Выделение гелия осуществляется в два этапа. Первый этап – получение гелиевого концентрата конденсацией при низкой температуре. И второй этап – очистка гелиевого концентрата от метана, водорода, азота, неона, аргона.
Все основные мировые запасы гелия находятся в Алжире, Катаре, США и России. Крупнейший производитель гелия – США. В России гелия добывается немного, так как основные его месторождения расположены в малоосвоенных месторождениях Дальнего Востока и Восточной Сибири.
Применение гелия
Гелий обладает высокой электропроводностью и теплопроводностью. Кроме того, у него очень низкая температура кипения, минус 268,94оС.
Область применения гелия очень широка.
Смесь газообразного гелия с кислородом применяют для снятия приступов астмы. Гелий гораздо хуже растворяется в крови, чем азот. Поэтому его используют в дыхательных смесях, подаваемых водолазам при глубоководных погружениях, для создания искусственной атмосферы космических кораблей и станций.
Многие технологические процессы в производстве невозможно проводить в воздушной среде из-за возможности вступления в реакцию с газами воздуха исходного сырья или получаемого продукта. И здесь на помощь приходит газообразный гелий, с помощью которого создают специальные защитные среды.
Отдельные стадии получения ядерного топлива проходят в гелиевой защитной среде. Тепловыделяющие элементы ядерных реакторов также транспортируют и хранят в контейнерах, заполненных гелем. Гелий применяется для выявления возможностей утечки в атомных реакторах. Используют гелий в газовых термометрах, переключателях высокого напряжения, в счётчиках нейтронов, для газовой смазки подшипников.
Как инертная среда гелий используется при дуговой сварке.
Гелием наполняют дирижабли и воздушные шарики.
Гелий не токсичен. И вдыхание небольшого количества гелия вместе с воздухом безвредно.
Источник: http://ximik.biz/himicheskie-elementi/94-gaz-geliy
Гелий
Как многие знают, самым распространенным и легким элементом на земле является водород, гелий же в нашем мире занимает второе место! Гелий — второй элемент периодической таблицы Менделеева является инертным одноатомным газом, не имеющим ни цвета, ни вкуса, ни запаха. Обладает самой низкой температурой кипения из всех веществ (-269 оС). Имеет 8 изотопов. Каждый из них уникален по своим свойствам.
История открытия
Первооткрывателем гелия по праву можно считать французского астронома, директора обсерватории в Медоне, Пьера Жюль Сезар Жансена. В 1868 году, при исследовании солнца, а именно хромосферы, астрономом была запечатлена линия ярко-желтого цвета, которую изначально и ошибочно отнесли к спектру натрия.
Но, спустя несколько лет, в 1871 году Пьер, совместно с английским астрономом Джозефом Локьером, установили, что линия, найденная Жансеном, не принадлежит ни одному из известных на тот момент химических элементов.
Название гелий получил, от слова «гелиос», что в переводе с греческого означает — солнце! В первую очередь, ученые предположили, что найденный элемент является металлом, но в наши дни, с уверенностью можно сказать — это было ложное предположение
Как многие знают, абсолютно все газы можно привести в жидкое состояние, но для этого, конечно, потребуются определенные условия. Сжиженный открыли только в 1908 году. Нидерландский физик Хейке Камерлинг-Оннес понижал давление газа с протеканием через дроссель, предварительно охладив гелий.
Твердый гелий, был получен только через 20 лет в 1926 году. Ученик Камерлинг-Оннеса, смог добиться получения кристаллов газа, увеличив давление гелия выше 35 атмосфер и охладив газ до предельно низкой температуры.
Интересные свойства гелия
Начнем с того, что гелий не может вступать в химические реакции вовсе, а так же не имеет степеней окисления.
Гелий – одноатомный газ, и имеет всего лишь один электронный уровень (оболочку), являясь крайне устойчивым газом, так как имеет полностью заполненный электронами первый уровень, что говорит о сильном воздействии ядра на электроны.
Атомы гелия, не то, что не реагируют с другими веществами, более того, они не соединяются даже друг с другом.
Жидкий гелий имеет ряд абсолютно уникальных свойств. В 30 годах 20-го века, при еще меньших температурах было замечено крайне странное и невероятное явление – когда гелий охлаждается до температуры всего на 2 градуса превышающей абсолютный ноль, происходит его неожиданная трансформация.
Поверхность жидкости становится абсолютно спокойной и гладкой, ни единого пузырька, ни малейшего бурления жидкости. Жидкий гелий превращается в сверхтекучую жидкость. Такой гелий может забраться по стенкам и «сбежать» из сосуда, в котором он хранится, это происходит из за нулевой вязкости сжиженного газа.
Он может стать фонтаном, обладающим нулевым трением, а значит, такой фонтан может течь бесконечно. Несмотря на все теории, ученые установили, что сжиженный гелий это непросто жидкость. Например, начиная с 2He, оказалось, что сжиженный газ состоит из двух взаимопроникающих жидкостей: нормальной (вязкой) и сверхтекучей (нулевая вязкость) компоненты.
Сверхтекучая компонента является идеальной и обладает нулевым трением, при протекании в любых сосудах и капиллярах.
Что же касается твердого гелия, то на данный момент, ученые проводят многочисленные опыты и эксперименты. Твердый 4He обладает квантовым эффектом, таким как кристаллизационная волна.
Этот эффект основан на колебании границы раздела фаз в системе – «кристалл – жидкость».
Достаточно немного качнуть такой гелий, и граница фаз между жидкостью и твердым веществом будет схожа с границей двух жидкостей!
Использование гелия в промышленности
В основном, гелий необходим для получения крайне низких температур, а так же в металлургии для выплавки чистых металлов. Так же 2He – это не только один из лучших теплоносителей, но и хороший пропеллент (Е939) в пищевой индустрии.
С помощью гелия можно определять местонахождение разломов в толще Земли, так как он выделяется при распаде радиоактивных элементов, которыми насыщена земная кора. Концентрация гелия на выходе из трещины, в 50 -100 раз больше, чем нормальная.
Более того, гелием наполняют воздушные суда, такие как дирижабли. Гелий намного легче чем воздух, поэтому подъемная сила таких судов очень высока. Да, водород легче, чем гелий. Так почему бы не использовать его? Водород – это горючий элемент, и заправлять им дирижабли крайне опасно.
Опасность
Любое превышение концентрации газа может быть опасным для здоровья человека. Вдыхание воздуха с высокой концентрацией гелия может вызвать потерю сознания, сильные , рвоту и даже смерть. Смерть наступает в результате кислородного голодания, связанного с тем что в легкие не попадает кислород.
Источник: http://www.alto-lab.ru/elements/gelij/
ГЕЛИЙ
ГЕЛИЙ, He (helium), химический элемент из семейства благородных (инертных) газов He, Ne, Ar, Kr, Xe, Rn, составляющих VIIIA подгруппу в периодической системе элементов, или, как ее еще называют, нулевую группу.
История открытия
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.
Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. «гелиос», что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле.
В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.
Резерфорд и Т.Ройдс установили, что -частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
Распространенность в природе
Содержание гелия в мировом пространстве составляет 28% (второе место после водорода). Гелий – основной компонент звездной материи. В результате углеродного цикла (сложная цепь ядерных реакций), впервые изученного Х.Бете в 1939, водород в звездном веществе превращается в гелий, при этом происходит значительное выделение энергии (см.
также ЯДЕРНЫЙ СИНТЕЗ). В земной атмосфере гелий составляет всего 0,0005% об., так как он чрезвычайно легок и слабо удерживается гравитационным полем земли. Гелий образуется при распаде тяжелых радиоактивных элементов, находящихся в расплавленном земном ядре, и медленно диффундирует через земную мантию.
Тепловая энергия, выделяющаяся при ядерных процессах, поддерживает ядро земли в расплавленном состоянии. Природный метан, добываемый из скважин, содержит ок. 1,75% гелия и 0,5% CO2. После удаления CO2, глубокого охлаждения природного газа до –185 C и сжатия образуется жидкий метан, а в газовой фазе остаются гелий и азот.
Метод глубокого охлаждения позволяет получать гелий чистотой 98% и выше.
Свойства
Гелий имеет одну-единственную электронную оболочку, занятую двумя электронами, т.е.
его оболочка полностью заполнена электронами, которые испытывают сильное притяжение ядра, а значит, очень устойчивы; поэтому гелий не вступает в химические реакции, не образует химические соединений и не имеет степеней окисления.
Гелий – бесцветный одноатомный газ без запаха; он не вступает в реакции ни с одним химическим элементом, и его атомы не соединяются даже между собой. Наиболее распространенный изотоп 4He содержит в ядре два протона и два нейтрона, поэтому его массовое число равно 4.
Более редкий изотоп 3He с одним нейтроном был открыт в 1939 Л.Альваресом и Р.Кернегом. Содержание 3He составляет 10–5% гелия, находящегося в природном газе, добываемом из скважин. 3He получается в ядерных реакциях при распаде трития (3H-изотоп водорода). Гелий – необычное вещество, по свойствам он близок к состоянию идеального газа
| 4He | |
| 2 | |
| 4,0026 | |
| 3 | 0,178 |
| –268,93 | |
| 5,25 | |
| 0,23 | |
| 0,0000003 | |
| – |
Жидкий и твердый гелий
Жидкий гелий обладает рядом уникальных свойств; он имеет самую низкую температуру кипения: 4He кипит при 4,22 K, а 3He – 3,19 K. Это свойство гелия используют для создания низких температур.
Гелий – единственное вещество на земле, которое при нормальном давлении не кристаллизуется вблизи абсолютного нуля, что объясняется слабым межатомным взаимодействием и квантовыми свойствами. Жидкий гелий бесцветен, очень текуч и имеет очень низкое поверхностное натяжение. Изотопы гелия в жидком состоянии сильно различаются.
Так, 4He имеет две формы: при температурах выше 2,18 K существует 4He, а ниже 2,18 K происходит необычный переход (фазовый переход второго рода) в 4He-II. Если пустой стеклянный сосуд погрузить в 4He-II, то жидкость будет медленно подниматься вверх по стенкам и перетекать внутрь до выравнивания уровней жидкости снаружи и внутри.
Если сосуд приподнять, то процесс пойдет обратно до нового выравнивания уровней жидкостей. Это – пленочное движение; оно характерно только для 4He-II. Другое аномальное свойство 4He-II – способность жидкости перетекать из области более низких температур в область более высоких.
4He-II обладает сверхтекучестью (явление сверхтекучести открыл П.Л.Капица в 1938) – свойством, известным только для жидкого гелия. Явление сверхтекучести объясняется на основе двухжидкостной модели.
Согласно ей, 4He-II состоит из двух полностью взаимопроникающих жидкостей – нормальной и сверхтекучей; последняя является идеальной жидкостью и не испытывает сопротивления при протекании через узкие капилляры. Согласно теории, в 4He-II существуют необычные температурные волны (второй звук). Объяснение аномалий 4He-II дается на основе представлений квантовой механики.
Жидкие 3He и 4He называются квантовыми жидкостями. 4He не имеет ядерного спина, а у 3He он равен 1/2 в единицах постоянной Планка. Удивительное различие состоит также в том, что 4He-II – сверхтекучая жидкость, а сопротивление текучести 3He резко возрастает с уменьшением температуры.
Гелий-3 становится, однако, сверхтекучим при температуре примерно 0,001 К, как было открыто в 1972. Это явление аналогично явлению сверхпроводимости, которая рассматривается как сверхтекучесть «электронной жидкости» (см. также СВЕРХПРОВОДИМОСТЬ). В 3He обнаружен новый тип звука при очень низких температурах, нулевой звук, предсказанный Л.Д.
Ландау и относящийся к волнам, характерным для ионизованных газов (плазмы). См. также СВЕРХТЕКУЧЕСТЬ.
Растворы изотопов гелия также необычны. Ниже 0,9 K раствор спонтанно делится на две части, образуя раствор, обогащенный 3He и текущий над раствором, обогащенным 4He. 6% 3He растворимы в 4He, но 4He не растворяется в 3He при абсолютном нуле.
Твердый гелий можно получить сжатием 4He до 25 атм или 3He до 34 атм при низких температурах. Твердый гелий – кристаллическое прозрачное вещество, причем границу между твердым и жидким гелием трудно обнаружить, так как их рефракции близки.
Применение
Гелий является важным источником низких температур. При температуре жидкого гелия тепловое движение атомов и свободных электронов в твердых телах практически отсутствует, что позволяет изучать многие новые явления, например сверхпроводимость в твердом состоянии.
Газообразный гелий используют как легкий газ для наполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполнения оболочки дирижабля.
Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений.
При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, – постоянный и опасный спутник работы водолаза. Смеси He–O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей.
Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов. Другие применения гелия – для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения.
В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств.
Необычным применением гелия в качестве хладагента является процесс непрерывного смешения 3He и 4He для создания и поддержания температур ниже 0,005 K.
Источник: https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/GELI.html
Пищевая добавка Е 939 (гелий): идеальный газ для настоящего и будущего
Слово «гелий» у большинства потребителей ассоциируется с праздником. Легкий газ поднимает высоко в небо воздушные шары. С его помощью несложно создать безопасные разноцветные облака с поздравлением.
Они будут плавно перемещаться под потолком. Вдыхание газа забавно меняет голос: на короткое время тембр повышается, создавая мультяшный эффект (звук в гелиевой атмосфере движется значительно быстрее воздуха).
Дарить радость — приятная, но далеко не единственная задача благородного газа. В пищевой индустрии гелий зарегистрирован как пищевая добавка E 939 (Е–939). Уникальное по химическим и физическим свойствам вещество защищает еду от заражения гнилостными бактериями, предохраняет от окислительной порчи.
Название продукта
В середине XIX века английский астроном Джозеф Норман Локьер и его коллега француз Жюль Жансен обнаружили в солнечных протуберанцах неизвестное вещество. Ученые назвали его гелий (от греческого «солнце»). С тех пор за вторым элементом химической системы Менделеева закреплено это название.
Международный синоним — Helium.
Тип вещества
СанПиН 2.3.2.1293-03 отводит добавке Е 939 роль пропеллента и защитного газа.
Основной промышленный способ получения гелия — выделение вещества из нефтяных и природных гелиеносных газов. Гелий является примесью, его содержание колеблется от 2 до 10% в зависимости от месторождения.
Отделяют благородный газ от других компонентов методом глубокого охлаждения. Сырая смесь содержит также водород (его убирают оксидом меди) и неон. Очистка проводится угольным сорбентом после охлаждения сырья в кипящем жидком азоте. Способ позволяет получить гелий высокой степени очистки. Такой газ идет на нужды пищевой промышленности, медицины.
Для остальных отраслей выпускают гелий технический. В его составе допустимо присутствие небольшого количества азота, аргона, водорода, неона, кислорода в виде примесей.
Гелий можно получить из сжиженного воздуха как побочный продукт при выделении аргона, азота и других ценных газов.
Выпускают продукт в виде газа или криогенной жидкости.
Свойства
| Показатель | Стандартные значения |
| Цвет | бесцветный |
| Состав | гелий. Химическая формула Не |
| Внешний вид | газ, может находиться в сжиженном состоянии |
| Запах | без запаха |
| Вкус | без вкуса |
| Содержание основного вещества | 99,985%% |
| Растворимость | хорошо в этаноле, средне в воде |
| Плотность вещества | 1,784 кг/м3 (при нормальном давлении) |
| Другие | химически инертный, не смешивается, не вступает в реакцию с другими веществами; отличается высокой теплопроводностью и проникающей способностью; имеет самую низкую температуру кипения: -268,94 °C; жидкий гелий обладает сверхтекучестью |
Упаковка
Добавку E 939 поставляют под давлением 150 атмосфер в стальных баллонах, соответствующих ГОСТ 949-73. Емкости должны быть окрашены в коричневый цвет, для обеспечения полной герметичности иметь мембранные вентили марки КВБ-53М (допустимы аналоги).
В зависимости от вида продукции баллоны маркируют надписями белого цвета «Гелий технический» или «Гелий высокой чистоты». Емкости помещают в специальные контейнеры.
Стандартный объем 40 литров. В розничную продажу (например, для наполнения воздушных шаров) разрешено поставлять гелий в баллонах меньшего объема (5, 10, 20 л).
Жидкий гелий перевозят в сосудах Дьюара, окрашенных в светло-серый цвет. Обязательное условие транспортировки и хранения — вертикальное положение.
Применение
Добавка Е 939 разрешена к применению во всех странах, кроме Новой Зеландии и Австралии.
Гелий используют для упаковки продуктов питания по технологии MAP (так называемая модифицированная газовая среда или регулируемая атмосфера).
Интересный факт! За основу метода был взят опыт английских предпринимателей. Начиная с 1930 года, они перевозили в газовой среде мясо из Австралии и Новой Зеландии. Сама же упаковка MAP была изобретена в 70-х годах.
Гелиевая среда защищает продукты от окисления, подавляет жизнедеятельность болезнетворных бактерий.
Гелий может быть использован в качестве пропеллента в аэрозолях малого объема.
Добавку E 939 применяют для упаковки и хранения:
- детского питания, жидких смесей-заменителей женского молока;
- продуктов, содержащих жиры и эфирные масла: какао, арахис, специи, кофе;
- овощей, фруктов (дополнительно гелий предохраняет продукты от высыхания, замедляет перезревание);
- кремы, сливки для взбивания.
Гелий не оказывает отрицательного воздействия на цвет, аромат, вкус, не разрушает витамины, полностью сохраняет биологическую ценность продуктов.
Некоторые западные производители применяют технологию обработки продуктов ионизирующим излучением изотопами цезия или кобальта в гелиевой среде («радиационная стерилизация»). Метод позволяет полностью уничтожить патогенные микроорганизмы внутри упаковки. Способ считается безопасным, но в нормативные документы пока не внесен.
Добавка Е 939 пользуется спросом в медицине.
Жидкий гелий применяют для охлаждения деталей аппаратов магнитно-резонансной томографии.
Газообразное вещество в качестве пропеллента используют в медицинских аэрозолях.
Смесь гелия и кислорода — эффективное средство для облегчения состояния при астме. Гелий обладает высокой проникающей способностью. Вдыхание подогретого газа:
- ускоряет транспорт кислорода, улучшает газообмен в легких;
- разжижает мокроту;
- восстанавливает кислотно-щелочной баланс;
- расслабляет гладкую мускулатуру, облегчая дыхание.
Лечебная смесь восстанавливает силы после тяжелых физических нагрузок, улучшает питание клеток, повышает сопротивляемость организма.
Гелиево-кислородная смесь хорошо зарекомендовала себя в терапии острых отравлений наркотическими и химическими веществами.
Лазер на основе гелия и неона — популярный атрибут современных медицинских и косметологических клиник. С его помощью ускоряют заживление ран, улучшают мозговое кровообращение, облегчают состояние при остеохондрозе. Гелий-неоновый лазер применяют для разрушения раковых клеток.
В косметологии прибор используют для лечения угревой сыпи, рассасывания рубцов.
При вдыхании допустимой концентрации гелий не вызывает состояния медикаментозного наркоза. Это свойство использовали производители смесей для водолазов. Состав из 99% гелия и 1% кислорода позволяет опускаться на глубину до 450 м.
Уникальные свойства гелия нашли применение в различных технических сферах:
- космонавтике (смесь для атмосферы обитаемых космических станций);
- топливной системе ракет;
- машиностроении (сварка);
- низкотемпературной, термоядерной и ядерной энергетике;
- воздухоплавании: наполнение аэростатов, дирижаблей и подобных летательных аппаратов.
Во многих отраслях гелий невозможно заменить другими веществами.
Польза и вред
Добавку E 939 можно отнести к нейтральным веществам. Сам по себе гелий нетоксичен. При попадании внутрь с продуктами питания не разрушает витамины и биологически значимые макро- и микроэлементы.
Опасность для человека представляет высокая концентрации газа в атмосфере. Народное развлечение — вдыхание гелия из воздушного шарика — далеко не безвредно, как принято считать.
Попадание большого количества газа в дыхательные пути может вызвать:
- тошноту, рвоту;
- головокружение;
- носовое кровотечение;
- потерю сознания.
Неисправный баллон с гелием или неплотно закрытый вентиль может стать причиной смерти от кислородного голодания! Газ не имеет запаха, его невозможно увидеть в атмосфере. Нарастающая постепенно концентрация становится критической. Человек внезапно впадает в кому.
Основные производители
Большая часть мировых запасов гелия сосредоточена в России и США.
Крупные месторождения гелиеносных газов есть в Республике Саха (Якутии), Астраханской, Оренбургской областях.
Экономическая ситуация развивается так, что в настоящее время товарный гелий производит единственное предприятие — завод «Газпром добыча Оренбург», дочерняя компания энергетической корпорации «Газпром».
Российский продукт имеет высокую себестоимость из-за низкого содержания гелия в природном газе.
Из 16 ведущих мировых заводов-изготовителей 13 находятся на территории США. В стране есть даже памятник гелию!
Крупнейшие — на месторождениях Хьюготон (штат Техас) и Райли Ридж (штат Вайоминг).
25% мирового гелия производит Катар (нефтегазовый гигант Qatar Petroleum), но блокада государства Саудовской Аравией сделала поставки невозможными.
Небольшие заводы по производству гелия есть во Франции, Китае, Австралии, Нидерландах.
Ученые уверены: уникальные свойства гелия найдут применение в технологиях будущего. Уже сейчас появилась новая наука — гелиеметрия.
Она изучает процессы проникновения инертного газа через различные сферы. Практическое применение исследования нашли в геологии: на основе полученных данных была составлена тектоническая карта поверхности Земли.
Это помогает определять глубинные разломы, обнаруживать залежи ценных руд.
Источник: https://vkusologia.ru/dobavki/antiflamingi/e939.html
Гелий
Ге́лий (He) — 2 элемент периодической системы элементов, газ.
Гелий — практически инертный химический элемент. Возглавляет группу инертных газов в периодической таблице. Нетоксичен, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ.
Его точка кипения (T = 4,216 K) наименьшая среди всех элементов; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при абсолютном нуле.
Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при стандартных температуре и давлении.
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3He (0,00014 %; содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Гелий занимает второе место по распространённости во Вселенной и лёгкости (после водорода). Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва, во время первичного нуклеосинтеза.
В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд. На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде — это ядра гелия-4).
Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. Фракционная дистилляция в статье Дистилляция).
История
Открытие гелия началось с 1868 года, когда при наблюдении солнечного затмения два астронома — француз П. Ж. Жансен и англичанин Д. Н.
Локьер — независимо друг от друга обнаружили в спектре солнечной короны жёлтую линию (она получила название D3-линии), которую нельзя было приписать ни одному из известных в то время элементов. В 1871 году Локьер объяснил её происхождение присутствием на Солнце нового элемента.
В 1895 году англичанин У. Рамзай выделил из природной радиоактивной руды клевеита газ, в спектре которого присутствовала та же D3-линия.
Происхождение названия
Локьер дал гелию имя, отражающее историю его открытия (от греч. Ήλιο (Helio) — солнце).
Поскольку Локьер полагал, что обнаруженный элемент — металл, он использовал в латинском названии элемента окончание «-ium» (соответствует русскому окончанию «-ий»), которое обычно употребляется в названии металлов.
Таким образом, гелий задолго до своего открытия на Земле получил имя, которое окончанием отличает его от названий остальных инертных газов.
Получение
В настоящее время гелий выделяют из природных гелийсодержащих газов, пользуясь методом глубокого охлаждения (гелий сжижается труднее всех остальных газов). Месторождения таких газов имеются в России, США, Канаде и ЮАР. Гелий содержится также в некоторых минералах (монаците, торианите и других), при этом из 1 кг минерала при нагревании можно выделить до 10 л гелия.
Свойства в газовой фазе
Гелий — наименее химически активный элемент нулевой группы (инертные газы) таблицы Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние.
Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или УФ излучения на смесь гелия газа и фтора (хлора)). При стандартных температуре и давлении гелий ведёт себя практически как идеальный газ. Фактически при всех условиях гелий моноатомный.
Он обладает теплопроводностью большей, чем у других газов, кроме водорода, и его удельная теплоёмкость чрезвычайно высока. Гелий также менее растворим в воде, чем любой другой известный газ. Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля-Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме.
Только ниже температуры инверсии Джоуля-Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры, гелий может быть превращён в жидкость при расширительном охлаждении.
Свойства конденсированных фаз
В 1908 году Х.Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 К (В.Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-IV при температуре 2,17K; назвал фазы гелий-I и гелий-II (ниже 2,17K). В 1938 году П. Л.
Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия, однако независимые эксперименты не подтвердили этот эффект.
Применение
Гелий используют для создания инертной и защитной атмосферы при сварке, резке и плавке металлов, при перекачивании ракетного топлива, для наполнения дирижаблей и аэростатов, как компонент активной среды гелий-неоновых лазеров.
Гелий-3 используется для наполнения газовых нейтронных детекторов, как рабочее тело гелиевых течеискателей.
Жидкий гелий, самая холодная жидкость на Земле, — уникальный хладагент в экспериментальной физике, позволяющий использовать сверхнизкие температуры в научных исследованиях (например, при изучении электрической сверхпроводимости).
Благодаря тому, что гелий очень плохо растворим в крови, его используют как составную часть газовой смеси, подаваемой для дыхания водолазам — замена азота воздуха на гелий предотвращает кессонную болезнь (при вдыхании обычного воздуха содержащийся в нём азот под повышенным давлением растворяется в крови, а при падении давления выделяется из неё в виде пузырьков, закупоривающих мелкие сосуды).
Ссылки
Категории:
- Химические элементы
- Благородные газы
Источник: http://mediaknowledge.ru/9c02edb2ab5002c1.html